
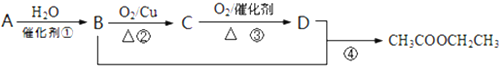
分析 A是石油裂解气的主要成分,现以A为主要原料合成乙酸乙酯,由转化关系可知,B为CH3CH2OH,D为CH3COOH,B氧化得到C为CH3CHO,C氧化可以CH3COOH,A与水发生加成反应得到CH3CH2OH,则A为CH2=CH2,据此解答.
解答 解:A是石油裂解气的主要成分,现以A为主要原料合成乙酸乙酯,由转化关系可知,B为CH3CH2OH,D为CH3COOH,B氧化得到C为CH3CHO,C氧化可以CH3COOH,A与水发生加成反应得到CH3CH2OH,则A为CH2=CH2,
(1)B为CH3CH2OH,含有官能团为:羟基,
故答案为:羟基;
(2)乙醇催化氧化生产乙醛,反应的化学方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,属于氧化反应
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,氧化反应;
(3)乙醛与银氨溶液发生银镜反应,反应的化学方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$2Ag↓+CH3COONH4+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$2Ag↓+CH3COONH4+3NH3+H2O;
(4)乙酸乙酯在碱性条件下水解的化学方程式:CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+HOCH2CH3,属于取代反应,
故答案为:CH3COOCH2CH3+NaOH$\stackrel{△}{→}$CH3COONa+HOCH2CH3;取代反应.
点评 本题考查无机物推断,涉及烯烃、醇、醛、羧酸的性质与转化,比较基础,侧重对基础知识的巩固.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
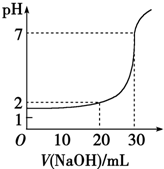 如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )
如图,对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象,可推出盐酸和NaOH溶液的物质的量浓度是表内各组中的( )| A | B | C | D | |
| c(HCl)/mol•L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
| c(NaOH)/mol•L-1 | 0.04 | 0.12 | 0.09 | 0.03 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 放热反应不一定不需要加热,但吸热反应一定需要加热 | |
| B. | 中和反应都是放热反应 | |
| C. | 氢气燃烧放出大量的热,说明参加反应的氢气和氧气总能量比生成物水的总能量低 | |
| D. | C与CO2反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子2个碳原子和4个氢原子不可能在同一个平面内 | |
| B. | 乙烯分子中键角约为109°28′,所有原子在同一个平面内 | |
| C. | 乙烯分子中碳碳双键的键能比乙烷分子中碳碳单键的键能小 | |
| D. | 乙烯比乙烷活泼,说明碳碳之间的π键比σ键键能小,易发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 太阳能的开发和利用是21世纪的一个重要课题.
太阳能的开发和利用是21世纪的一个重要课题.| 盐 | 熔点/℃ | 熔化吸热/KJ•mol-1 | 参考价格/元•kg-1 |
| CaCl2•6H2O | 29.0 | 37.3 | 780~850 |
| Na2SO4•10H2O | 32.4 | 77.0 | 800~900 |
| Na2HPO4•12H2O | 36.1 | 100.1 | 1600~2000 |
| Na2S2O3•5H2O | 48.5 | 49.7 | 1400~1800 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com