
| 滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.01 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.30 | 20.30 |
分析 (1)氨水溶液中一水合氨为弱电解质存在电离平衡,硫酸铵水溶液中铵根离子水解促进水电离平衡正向进行溶液显酸性;
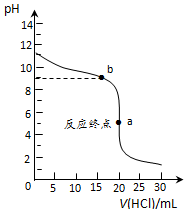
(2)①用0.1000mol•L-1盐酸滴定0.1000mol•L-1氨水恰好反应生成氯化铵,溶液显酸性,选择指示剂应是变色范围在酸性条件;
②a点为反应终点,生成的是氯化铵溶液,铵根离子水解溶液显酸性;
③b点溶液PH=9,结合平衡常数 计算式和溶液中满足4c(NH4+)=7c(NH3•H2O),计算得到定量平衡常数;
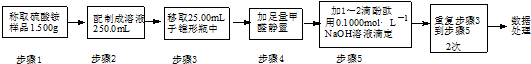
(3)称取硫酸铵样品1.500g,配制250.00ml,移取25.00ml溶液于锥形瓶中,加入足量甲醛溶液,加入指示剂酚酞试液,用0.1000mol/L氢氧化钠溶液滴定到变红色达到反应终点,结合标准溶液消耗体积和浓度计算物质的量,利用化学方程式定量关系4NH4++6HCHO═4H++(CH2)6N4+6H2O; H++OH-═H2O,计算得到铵根离子物质的量,氮元素守恒计算含氮量.
解答 解:(1)氨水溶液中一水合氨为弱电解质存在电离平衡,电离方程式为:NH3•H2O?NH4++OH-,硫酸铵水溶液中铵根离子水解促进水电离平衡正向进行溶液显酸性水解离子方程式为:NH4++H2O?NH3•H2O+H+,
故答案为:NH3•H2O?NH4++OH-;NH4++H2O?NH3•H2O+H+;
(2)①甲基橙变色范围为3.1-4.4,酚酞变色范围为8-10,石蕊变色范围大一般不做滴定指示剂,用0.1000mol•L-1盐酸滴定0.1000mol•L-1氨水恰好反应生成氯化铵,溶液显酸性,所以选择甲基橙做指示剂,
故答案为:甲基橙;
②a点为反应终点,生成的是氯化铵溶液,铵根离子水解溶液显酸性,离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
③b点溶液PH=9,结合平衡常数 计算式和溶液中满足4c(NH4+)=7c(NH3•H2O),一水合氨电离平衡常数K=$\frac{c(N{{H}_{4}}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{7×1{0}^{-9}}{4}$=1.75×10-5,
故答案为:1.75×10-5;
(3)称取硫酸铵样品1.500g,配制250.00ml,移取25.00ml溶液于锥形瓶中,加入足量甲醛溶液,加入指示剂酚酞试液,用0.1000mol/L氢氧化钠溶液滴定到变红色达到反应终点,结合标准溶液消耗体积和浓度计算物质的量,利用化学方程式定量关系4NH4++6HCHO═4H++(CH2)6N4+6H2O; H++OH-═H2O,
依据图表数据计算平均消耗溶液体积V=$\frac{20.01ml+19.99ml+20.00ml}{3}$=20.00ml,结合元素守恒,
n(N)=n(NH4+)=n(NaOH)=0.1000mol•L-1×20.00mL×10-3L•mL-1=2.000×10-3mol,
w(N)=$\frac{14g/mol×2.000×1{0}^{-3}mol}{1.500g×\frac{25.00mL}{250.0mL}}$≈18.67%,
故答案为:计算平均消耗溶液体积V=$\frac{20.01ml+19.99ml+20.00ml}{3}$=20.00ml,
结合元素守恒,n(N)=n(NH4+)=n(NaOH)=0.1000mol•L-1×20.00mL×10-3L•mL-1=2.000×10-3mol,w(N)=$\frac{14g/mol×2.000×1{0}^{-3}mol}{1.500g×\frac{25.00mL}{250.0mL}}$≈18.67%;
点评 本题考查了弱电解质定量平衡、盐类水解、滴定实验的过程分析和计算应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 某溶液为蓝色,则该溶液一定是CuSO4溶液 | |
| B. | 向某溶液中加入Ba(NO3)2溶液无明显现象,再滴入几滴硝酸酸化的AgNO3溶液,产生白色沉淀,说明原溶液中含有Cl- | |
| C. | 向某溶液中加入CaCl2溶液,产生白色沉淀,则溶液中一定含有Ag+ | |
| D. | 加入稀HNO3酸化的BaCl2溶液,有白色沉淀生成,证明原溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
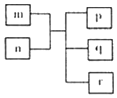 短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )| A. | 原子半径Y<Z<W | |
| B. | 简单气态氢化物的稳定性Y>Z>W | |
| C. | 简单气态氢化物沸点Y>Z | |
| D. | X、Z、W三种元素可以形成离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
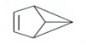 盆烯是近年来运用立体空间化学制造出来的空间单烯烃,因其分子形似瓦盆,故称为盆烯,其结构简式如图所示.下列关于盆烯的说法中正确的是( )
盆烯是近年来运用立体空间化学制造出来的空间单烯烃,因其分子形似瓦盆,故称为盆烯,其结构简式如图所示.下列关于盆烯的说法中正确的是( )| A. | 分子式为C6H8 | |
| B. | 是乙烯的一种同系物 | |
| C. | 在一定条件下可以发生加成、氧化反应 | |
| D. | 1 mol盆烯完全燃烧需消耗6.5molO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
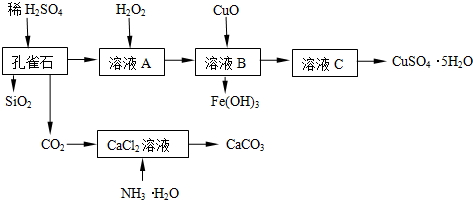
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 COOCH2CH2CH(OH3)2.合成路线如下:
COOCH2CH2CH(OH3)2.合成路线如下: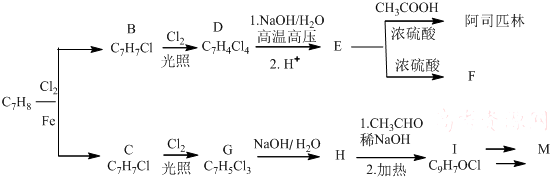
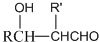 $\stackrel{加热}{→}$H2O+
$\stackrel{加热}{→}$H2O+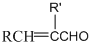
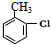 ,由H生成I的第二步反应的反应类型是消去反应.
,由H生成I的第二步反应的反应类型是消去反应.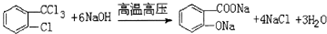 .E→F
.E→F .
.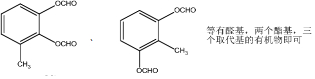 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 用胆矾晶体(CuSO4•5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题
用胆矾晶体(CuSO4•5H2O )配制0.40mol/L的CuSO4溶液240mL,回答下列问题查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com