
| A. | X极为负极,Y极为正极 | |
| B. | 工作一段时间后,KOH的物质的量不变 | |
| C. | 电池工作时甲烷一极附近溶液的pH减小 | |
| D. | 该在标准状况下通入5.6 L O2完全反应,则有1.0mol电子发生转移 |
分析 碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,根据电极反应确定液的pH变化情况以及电子转移和物质量之间的关系.
解答 解:A、碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,所以X极是负极,通入氧气的一极为原电池的正极,发生还原反应,Y极为正极,故A正确;
B、根据总反应:CH4+2O2+2OH-=CO32-+3H2O,则氢氧化钾被消耗,物质的量减小,故B错误;
C、该电池工作时甲烷电极发生的电极反应为:CH4+10OH--8e-=CO32-+7H2O,该极氢氧根被消耗,所以该极附近溶液的pH降低,故C正确;
D、在标准状况下通入5.6L即0.25molO2完全反应,根据电极反应式:O2+2H2O+4e-=4OH-,转移电子是1.0mol,故D正确;
故选B.
点评 本题考查碱性甲烷电池的工作原理,题目难度不大,本题中注意把握电极反应式的书写,正确判断两极的化学反应.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
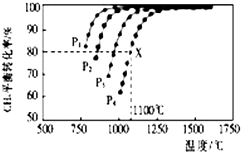 在密闭容器中通入物质的量浓度均为0.1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.
在密闭容器中通入物质的量浓度均为0.1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
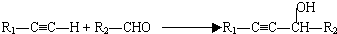 (R代表烃基,下同.)
(R代表烃基,下同.)
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
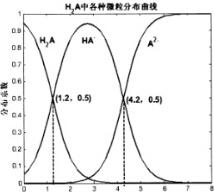 常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分数系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分数系数)随pH变化的关系如图所示.下列表述不正确的是( )| A. | H2A?2H++A2- K=10-5.4 | |
| B. | 在0.1mo/LNaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 已知25℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量的NaF溶液中,发生的反应为:H2A+F-═HF+HA- | |
| D. | 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 用pH计测得次氯酸钠溶液的pH>7 | HClO是弱酸 |
| B | 向10mL0.1 mol/L NaOH溶液中加入1mL 0.1mol/LMgCl2溶液,然后再向混合溶液中 滴加CuCl2溶液,产生蓝色沉淀 | 溶度积:Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 在淀粉溶液中加入稀硫酸,水浴加热,一段 时间后,滴入几滴碘水,溶液变为蓝色 | 淀粉没有水解 |
| D | 在未知溶液中滴加BaCl2溶液出现白色沉淀, 加稀硝酸,沉淀不溶解 | 该未知溶液中存在SO42-或SO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
,并推测1molNH4BF4(氟硼酸铵)中含有2NA个配位键.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
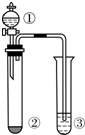 下表所列实验探究,利用如图所示实验装置,能得出相应实验结论的是( )
下表所列实验探究,利用如图所示实验装置,能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 水 | 电石 | CuSO4溶液 | 乙炔具有还原性 |
| B | 浓硝酸 | Cu | KI-淀粉溶液 | 氧化性:NO2>KI |
| C | 浓盐酸 | KMnO4 | KI-淀粉溶液 | 氧化性:KMnO4>Cl2>I2 |
| D | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | 溶解度:AgCl>Ag2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com