
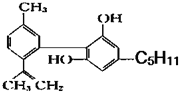
 :回答下列问题:大麻酚的分子式为:C21H26O2,它与足量的溴水反应最多消耗Br23mol.
:回答下列问题:大麻酚的分子式为:C21H26O2,它与足量的溴水反应最多消耗Br23mol.  阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖(C6H12O6)与蔗糖(C12H22O11) | B. | 醋酸与甲酸甲酯(C2H4O2) | ||
| C. | 乙醇与甲醛(CH2O) | D. | 二甲醚(C2H6O)与乳酸(C3H6O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
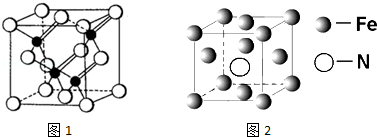
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
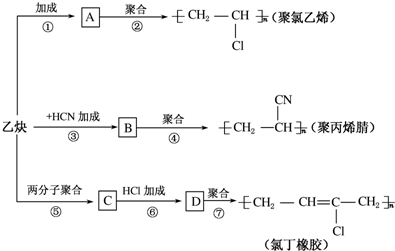
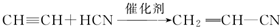 ;
;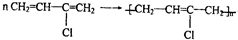 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
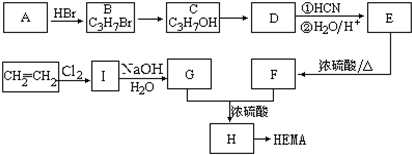
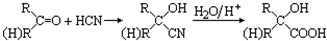
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
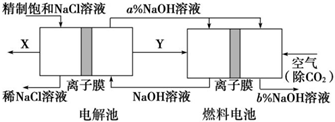
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 次数 | 1 | 2 | 3 |
| 滴定体积/mL | 19.98 | 20.02 | 19.00 |
| 实验编号 | 实验操作 | 现象 |
| 1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 无白色沉淀生成 |
| 2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振荡,再滴加酸性KMnO4溶液 | 紫红色不褪去 |
| 3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根洁净的Ag丝,并滴加NaCl溶液 | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇在铜作催化剂的条件下加热和空气的反应 | |
| B. | 乙烯通入溴的四氯化碳溶液中的反应 | |
| C. | 甲烷在光照条件下与氯气发生的反应 | |
| D. | 苯与液溴在铁粉作催化剂的条件下发生的反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com