
②C(g)+H2O(g)====CO(g)+H2(g);ΔΗ=-131.3 kJ·mol-1
③0.5H2SO4(l)+NaOH(l)====0.5Na2SO4(l)+H2O(l);ΔΗ=-57.3 kJ·mol-1
④C(s)+O2(g)====CO2(g);ΔΗ=-393.5 kJ·mol-1
⑤CO(g)+![]() O2(g)====CO2(g);ΔΗ=-283 kJ·mol-1
O2(g)====CO2(g);ΔΗ=-283 kJ·mol-1
⑥HNO3(aq)+NaOH(aq)====NaNO3(aq)+H2O(l);ΔΗ=-57.3 kJ·mol-1
⑦2H2(g)+O2(g)====H2O(l);ΔΗ=-517.6 kJ·mol-1
(1)上述热化学方程式中,不正确的有___________,不正确的理由分别是________________。
(2)根据上述信息,写出C转化为CO的热化学方程式:______________________。
(3)上述反应中,表示燃烧热的化学方程式有________________,表示中和热的热化学方程式有____________________________________________。
解析:本题主要考查燃烧热、中和热的有关概念及热化学方程式的书写与其正误判断。(1)题中给定的热化学方程式中①②③不正确,①漏写状态和“+”号;②该反应应为吸热反应;③物质的状态标错。(2)将热化学方程式④与⑤相减整理即可。(3)由燃烧热、中和热的概念可知:表示燃烧热的热化学方程式中可燃物质的化学计量数为1,且生成物为稳定的氧化物;表示中和热的热化学方程式中的生成物水的化学计量数应为1。
答案:(1)①②③ ①CaO的状态没有写,且ΔΗ的“+”号没有标,②应为“ΔΗ=+131.3 kJ·mol-1”,③除H2O外,其余物质的状态应改为“aq” (2)C(s)+![]() O2(g)CO(g);ΔΗ=-110.5 kJ·mol-1 (3) ④⑤ ⑥
O2(g)CO(g);ΔΗ=-110.5 kJ·mol-1 (3) ④⑤ ⑥


科目:高中化学 来源: 题型:
A.溶解少量食盐于水中,ΔS>0?
B.碳和氧气反应生成CO(g),ΔS>0?
C.H2O(g)变成液态水,ΔS>0?
D.CaCO3(s)加热分解为CaO(s)和CO2(g),ΔS>0?
查看答案和解析>>
科目:高中化学 来源:2015届重庆市高二上学期期中考试化学试卷(解析版) 题型:填空题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下溶解平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
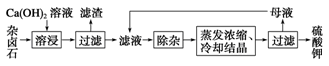
(1)滤渣主要成分有________和CaSO4以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。由图可得,随着温度升高,
① ,
② ,

③溶浸出的K+的平衡浓度增大。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32- CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K=
。
CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K=
。
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高二下学期期中考试化学试卷(解析版) 题型:选择题
下列变化过程中,ΔS<0的是
A.氯化钠溶于水中 B.NH3(g)和HCl(g)反应生成NH4Cl
C.干冰的升华 D.CaCO3(S)分解为CaO(S)和CO2(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com