
| 物质 | X | Y | Z |
| 初始物质的量/mol | 2 | 4 | 0 |
| 4 min末物质的量/ihol | 1.6 | 2.8 | a |
| 平衡物质的量/mol | 1 | b | 2 |
| A. | a=0.8 | |
| B. | t℃该反应的平衡常数为4 | |
| C. | 前4min内,用Z的变化量表示的平均反应速率V(Z)=0.1mol•L-1•min-1 | |
| D. | 升高平衡后的体系温度,V逆:增大,V正增大,平衡向逆反应方向移动 |
分析 发生反应:X(g)+3Y(g)?2Z(g)
初始:(mol) 2 4 0
变化量:(mol)1 3 2
平衡:(mol) 1 1 2,
平衡时各组分浓度为:c(X)=$\frac{1mol}{2L}$0.5mol/L、c(Y)=$\frac{1mol}{2L}$=0.5mol/L、c(Z)=$\frac{2mol}{2L}$=1mol/L,
A.4min时X的物质的量变化为:2mol-1.6mol=0.4mol,根据计量数关系计算出a;
B.根据平衡常数的概念及表达式计算出该反应的平衡常数;
C.根据A可知a=0.8,则前4min内,根据v=$\frac{\frac{△n}{V}}{△t}$进行计算;
D.该反应为放热反应,升高温度后正逆反应速率都增大,平衡向着逆向移动,据此进行解答.
解答 解:发生反应:X(g)+3Y(g)?2Z(g)
初始:(mol) 2 4 0
变化量:(mol)1 3 2
平衡:(mol) 1 1 2,
平衡时各组分浓度为:c(X)=$\frac{1mol}{2L}$0.5mol/L、c(Y)=$\frac{1mol}{2L}$=0.5mol/L、c(Z)=$\frac{2mol}{2L}$=1mol/L,
A.4min时X的物质的量变化为:2mol-1.6mol=0.4mol,根据反应可知,此时Z的物质的量为:0.4mol×2=0.8mol,即a=0.8,故A正确;
B.该温度下该反应的平衡常数为:K=$\frac{{1}^{2}}{0.{5}^{3}×0.5}$=16,故B错误;
C.根据A可知a=0.8,则前4min内,用Z的变化量表示的平均反应速率V(Z)=$\frac{\frac{0.8mol}{2L}}{4min}$=0.1mol•L-1•min-1 ,故C正确;
D.该反应为放热反应,升高温度后平衡向着逆向移动,且正逆反应速率都增大,故D正确;
故选B.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的分析能力及化学计算能力.


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | |
| 浓度1 | 0.05mol•L-1 | a mol•L-1 | 0.05mol•L-1 |
| 浓度2 | 0.078mol•L-1 | 0.078mol•L-1 | 0.022mol•L-1 |
| 浓度3 | 0.06mol•L-1 | 0.06mol•L-1 | 0.04mol•L-1 |
| 浓度4 | 0.07mol•L-1 | 0.07mol•L-1 | 0.098mol•L-1 |
| A. | 由[浓度3]与[浓度1]的比较,可判断平衡移动的原因是增大了体系的压强 | |
| B. | 由[浓度2]与[浓度1]的比较,可判断正反应是放热反应 | |
| C. | [浓度1]中a=0.05 | |
| D. | 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4].与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的木炭与CO2的反应 | |
| C. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| D. | 甲烷在空气中燃烧的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
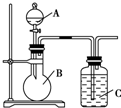 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
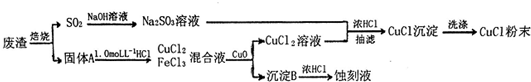
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
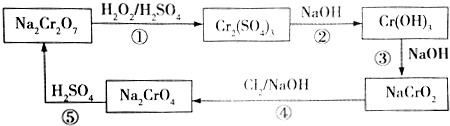
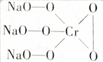 ,则Cr的化合价为+5,其中含有的化学键有离子键、共价键.
,则Cr的化合价为+5,其中含有的化学键有离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com