


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.①② | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 某钠盐溶液中加入盐酸酸化的硝酸钡溶液有白色沉淀 | 说明该钠盐是硫酸钠或硫酸氢钠 |
| B | 向混有乙酸和乙醇的乙酸乙酯的混合物中,加入饱和Na2CO3溶液洗涤、分液 | 得到较纯净的乙酸乙酯 |
| C | 向裂化汽油中加入酸性高锰酸钾溶液,振荡,紫色褪去 | 说明汽油中含有甲苯等苯的同系物 |
| D | 向含有少量的FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液 | 除去FeCl2溶液中的FeBr2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 目的 | 分离方法 |
| A | 提取NaCl溶液中的碘单质 | 乙醇萃取 |
| B | 分离乙酸乙酯和饱和Na2CO3溶液 | 分液 |
| C | 除去NaCl固体中的NH4Cl | 加热 |
| D | 除去Cl2中的HCl | 饱和食盐水洗气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②一⑥一④一①一③一⑤ | B.②一①一⑥一③一④一⑤ |
| C.②一①一③一⑥一⑤一④ | D.②一③一①一⑥一⑤一④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
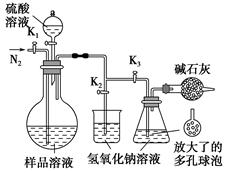
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验序号 | 实验 | 实验现象 | 结论 |
| 实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | ①气体成分为________ |
| 实验Ⅲ | ②取实验Ⅰ中的白色不溶物,洗涤,加入足量________ | ③________________ __________________ __________________ | 白色不溶物可能含有MgCO3 |
| 实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | ④溶液中存在________ |
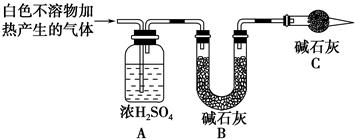
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
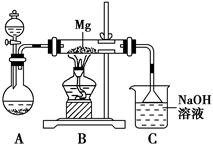
 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2 2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后所得固体于试管中 | |
| ② | 向试管中的固体慢慢滴加____________,试管口塞上带导管的单孔塞,并将导管通入盛有________的试管中 | 若试管中的________,则丙同学推测正确,若试管中的固体未完全溶解,且________,则乙同学推测正确 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com