
【题目】铁制自来水管与下列材料做成的水龙头连接,自来水管锈蚀最快的是( )
A.铁水龙头
B.铜水龙头
C.塑料水龙头
D.陶瓷水龙头
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】用如图所示装置和相应试剂能达到实验目的是:
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:S>C>Si | 稀硫酸 | Na2CO3 | Na2SiO3溶液 |
|
B | 制备纯净的氯气 | 浓盐酸 | MnO2 | 饱和食盐水 | |
C | 检验溶液X中含有CO32- | 盐酸 | 溶液X | 澄清石灰水 | |
D | 除去Na2CO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某复合材料是由碳纤维为增强体、金属钛为基体复合而成的。估计这种材料( )
①耐高温 ②不耐热 ③导电、导热 ④不导电、不导热 ⑤可用于飞机机翼 ⑥可用于导弹的壳体
A.①③⑤⑥
B.②③⑤⑥
C.②③④
D.③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容的密闭容器中进行如下反应:A(g)+2B(g)3C(g)+D(g),
(1)此反应在四种不同情况下的反应速率分别为:
①v(A)=5molL﹣1min﹣1
②v(B)=6molL﹣1min﹣1
③v(C)=4.5molL﹣1min﹣1
④v(D)=8molL﹣1min﹣1
其中反应速率最快的是(填编号).
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同) .
A.容器内压强不再发生变化
B.C的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2n mol B的同时消耗n molA
E.气体密度保持不变
F.气体的平均摩尔质量保持不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是
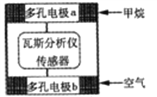
A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极b是正极,O2-由电极a流向电极b
C. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
D. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型高效的甲烷燃料电池两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组进行如下的实验,根据装置图回答下列问题:
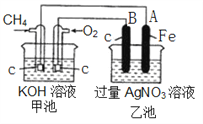
(1)通入CH4的电极的电极反应式是__________ ,A的电极反应式是______________ 。
(2)通电一段时间后,乙池中溶液的pH_________(填“升高”“降低”或“不变”),当乙池中某一电极质量增加 10.8g时,电路中有______ mol电子通过,理论上甲池中共消耗气体 _________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯和乙烯都是石油化工最重要的基础原料,可用于生产多种重要的有机化工产品。主要的工业生产途径如下:
途径I:CH3CH2CH3(g) ![]() CH2=CHCH3(g)+H2(g) △H1
CH2=CHCH3(g)+H2(g) △H1
途径II :nCH3OH(g) ![]() CnH2n(g)+nH2O(g)(n为2或3) △H2<0
CnH2n(g)+nH2O(g)(n为2或3) △H2<0
回答下列问题:
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2219.9 kJ·mol-1 、2056.5 kJ·mol-1 和285.8 kJ·mol-1 ,则△H1=________ kJ·mol-1 。
(2)途径I制备丙烯,要提高丙烯的产率最好采用____________条件。(填“高压”或“低压”)
(3)途径II控制适当的条件(温度、压强、催化剂等)可以调节N(N=n(乙烯)/n(丙烯))在0~1.5之向变化,回答下列问题:
①要大幅度提高丙烯在最终产物中的比率,需要控制的适当条件是______________________。
②在体积为1m3的反应器中投入0.64t甲醇,1h 后,反应器中的压强增加了30%,则甲醇的转化率为______(用N=1进行计算)。
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2 和CO2,负极通入丙烷,电解质是熔融碳酸盐。
①写出该电池负极的电极反应式:_____________,CO32-移向电池的___极 (填“正”或“负”)。
②当电池消耗0.005mol C3H8时,正极消耗气体的总体积为_____L (标准状况下)。
③用该电池电解1000mL1mol/L的AgNO3溶液、此电解池的总反应方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com