
| Q |
| n |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| Q |
| n |
| 1128.6J |
| 0.05L×0.5mol/L |


科目:高中化学 来源: 题型:
| A、Mg2+、Ca2+、HCO3-、Cl- |
| B、Na+、Mg2+、Cl-、SO42- |
| C、K+、Fe3+、Cl-、SO42- |
| D、Ba2+、Al3+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
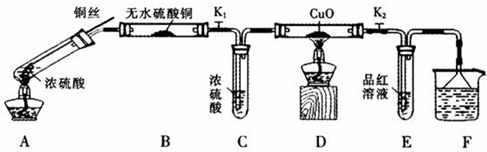
| 硫酸/mol?L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 15 | 约150 | 约236 |
| 16 | 约150 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,常温常压下气体X(见选项)与O2等物质的量混合后充满圆底烧瓶,挤压胶头滴管并打开止水夹,可观察到烧杯中的水沿导管进入烧瓶.长时间充分反应后,烧瓶中所得溶液的物质的量浓度最小的是(假设溶质不向烧瓶外扩散)( )
如图所示,常温常压下气体X(见选项)与O2等物质的量混合后充满圆底烧瓶,挤压胶头滴管并打开止水夹,可观察到烧杯中的水沿导管进入烧瓶.长时间充分反应后,烧瓶中所得溶液的物质的量浓度最小的是(假设溶质不向烧瓶外扩散)( )| A、NH3 |
| B、HCl |
| C、SO2 |
| D、NO2(假设不含N2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅原子和钠原子 |
| B、硼原子和氦原子 |
| C、氯原子和碳原子 |
| D、碳原子和铝原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
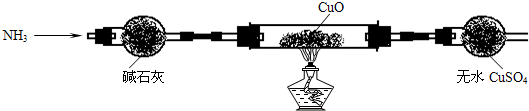
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤⑥⑦ |
| B、②③⑦⑤⑥ |
| C、②⑤⑦⑥① |
| D、④③⑦⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、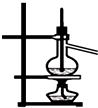 分离沸点相差较大液体混合物 |
B、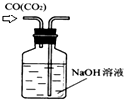 除去CO气体中的CO2气体 |
C、 向容量瓶中转移液体 |
D、 分离互不相溶的两种液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com