
����Ŀ����ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ�����ͼ1�� 
��1�����оٺ�ˮ���������ַ������� ��
��2������I�м����Br2 �� ����II���ֽ�Br2��ԭΪBr�� �� ��Ŀ���� ��
��3������II��SO2ˮ��Һ����Br2 �� �����ʿɴ�95%���йط�Ӧ�����ӷ���ʽΪ ��
��4��ij��ѧ�о���ѧϰС��Ϊ���˽�ӹ�ҵ�����ᴿ��ķ������������й�����֪��Br2�ķе�Ϊ59�森����ˮ���ж�����ǿ��ʴ�ԣ����Dzι��������̺�����ͼ2װ�ü�ͼ�� 
�������������ۣ�
��ͼ������B�������� ��
������ʵ��װ�����������Ӿ��������������ܣ���ԭ���� ��
��ʵ��װ�����������ã�Ҫ�ﵽ�ᴿ���Ŀ�ģ���������ο��ƹؼ������� ��
��C��Һ����ɫΪ �� Ϊ��ȥ�ò������Բ���������Cl2 �� �������м���NaBr����Һ����ַ�Ӧ���ٽ��еķ�������� ��
���𰸡�
��1���������������������ӽ�����
��2��������Ԫ��
��3��SO2+Br2+2H2O=4H++SO42��+2Br��
��4�������ܣ������ǿ��ʴ�ԣ����Ը�ʴ��Ҫ�����¶ȼ�b���¶ȣ����ռ�59��ʱ����֣����غ�ɫ�����ɫ����ȡ����Һ
���������⣺��1��Ŀǰ������ˮ�ķ����ж��֣��磺�������������������ӽ�������ˮ������ܼ���ȡ���ͱ����������Դ��ǣ��������������������ӽ���������2����������ѻ��Br2 �� ��������ֽ�Br2��ԭΪBr�� �� Ŀ���ǵ�Ũ�ȵ�Br2��Һ����ȡʱ���Ĺ����ԭ�Ϻ���Դ��ת��ΪHBr���ױ���������������Ϊ�嵥�ʣ����ڸ�����Ԫ�أ����Դ��ǣ�������Ԫ�أ���3���������������嵥�ʷ���������ԭ��Ӧ������������廯�⣬��Ӧ�����ӷ���ʽΪ��Br2+SO2+2H2O�T4H++SO42��+2Br�� �� ���Դ��ǣ�SO2+Br2+2H2O=4H++SO42��+2Br������4������װ��ͼ��֪���ᴿ�����õ�ԭ������������BΪ�����ܣ����Դ��ǣ������ܣ����嵥����һ��ǿ������������ǿ��ʴ����ʴ����Ʒ����������װ�ò������������ܣ����Դ��ǣ������ǿ��ʴ�ԣ����Ը�ʴ�� �ۿ����¶�59�棬ʹ�嵥�ʻӷ������ռ�59��ʱ����֣�ͨ�������õ��������ɫ�����ɫ��Һ̬�嵥�ʣ����Դ��ǣ�Ҫ�����¶ȼ�b���¶ȣ����ռ�59��ʱ����֣���C��Һ��Ϊ�������Һ�壬Һ����ɫΪ���غ�ɫ�����ɫ��Ϊ��ȥ�ò������Բ���������Cl2 �� �������м���NaBr��Һ����ַ�Ӧ��Cl2+2Br��=Br2+2Cl�� �� �ٽ��еķ�������Ǽ�����ȡ����ȡ��Һ��������õ�Һ�壬���Դ��ǣ������ɫ����ȡ����Һ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йؽ������ʵ�������ȷ���ǣ� ��
A.�����кܸߵ��۵�
B.�������������� 3 ���Ķ��ǽ���
C.���ܵ��硢����
D.��ֻ�ܺ���ܺͼ����ѧ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����Ԫ��R��ԭ�Ӻ������������6�����ӣ������������Ļ�ѧʽΪ�� ��
A.RO
B.RO2
C.RO3
D.RO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ƬͶ��ŨH2SO4�У�����˵����ȷ���ǣ� ��
A.��������Ӧ
B.�����ۻ�
C.��������SO2
D.��������H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ܿ������ܡ����ܵ��ת�������б�������ȷ���ǣ� �� 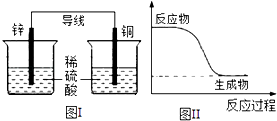
A.��ѧ��Ӧ�������仯����Ҫԭ���ǻ�ѧ���Ķ������γ�
B.�кͷ�Ӧ�У���Ӧ��������������������������
C.ͼI��ʾ��װ���ܽ���ѧ��ת��Ϊ����
D.ͼII��ʾ�ķ�ӦΪ���ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����һ���Ϊ2 L���ܱ������У�ͨ��112 g N2��24 g��H2 �� ��ʱ������ѹǿΪp����ѹ���ڸ��¶Ⱥʹ��������£�H2��N2��Ӧ�ﵽƽ�⣬���ƽ��ʱѹǿΪ0.95p����ѹ������˵������ȷ����(����)
A.ƽ��ʱ��N2���ʵ�����3.6 mol
B.ƽ��ʱ��H2�����ʵ�����10.8 mol
C.ƽ��ʱ��N2��ת����10%
D.NH3������ٷֺ�����10%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���穁Fenton��������ˮ�����л���Ⱦ�オ��ĸ������������䷴Ӧԭ����ͼ��ʾ�����е�������H2O2��Fe2+����Fenton��Ӧ��Fe2++H2O2=Fe3++OH��+OH�����ɵ��������ɻ���OH�������������л���Ⱦ�����˵������ȷ���ǣ� �� 
A.��Դ��A���Ǹ���
B.������ֻ��O2��Fe3+������ԭ��Ӧ
C.�����Ϸ����缫��Ӧ��H2O��e��=OH+H+ ��
D.����1molO2 �� ���Բ���4molOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��N2(g)��3H2(g) ![]() 2NH3(g)(����ӦΪ���ȷ�Ӧ)��2SO2(g)��O2(g)
2NH3(g)(����ӦΪ���ȷ�Ӧ)��2SO2(g)��O2(g)![]() 2SO3(g)(����ӦΪ���ȷ�Ӧ)��
2SO3(g)(����ӦΪ���ȷ�Ӧ)��
��ش��������⣺
��1����Ӱ�컯ѧ��Ӧ���ʺͻ�ѧƽ������ط�����Ҫ������NH3��SO3�����ɣ�������Ӧ��ȡ�Ĵ�ʩ����ʵ�������в�ȡ�Ĵ�ʩ���� ��
��2���ںϳɰ��Ĺ�ҵ�����У�Ҫ���������Ŀ���������ϳ�SO3�Ĺ����У�����Ҫ�����SO3 �� ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʢ�б���̼������Һ���ձ��в�����Ե缫�������¶Ȳ��䣬ͨ��һ��ʱ���
A.��Һ��pH����B.Na+ ��CO32-��Ũ�ȼ�С
C.��Һ��Ũ������D.��Һ��Ũ�Ȳ��䣬�о�������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com