
(16分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为产生温室效应的主要气体。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为__________________________。
(2)B的氢化物分子的立体构型是________ ,其中心原子采取________杂化。
(3)写出化合物AC2的电子式________ ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为________。
(4)E的核外电子排布式是________ ,ECl3形成的配合物的化学式为________。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是________________________________________________________。
(1)C<O<N (2)三角锥形 sp3
(3) 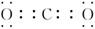 N2O
N2O
(4)1s22s22p63s23p63d54s1(或[Ar]3d54s1) [Cr(NH3)4(H2O)2]Cl3
(5)4Mg+10HNO3===4Mg(NO3)2+NH4NO3+3H2O
【解析】AC2为产生温室效应的主要气体,所以A是碳元素,C是氧元素。因为B的原子序数大于A的,小于C的,所以B是氮元素。D的二价阳离子与C的阴离子具有相同的电子层结构,则D是镁元素。E的原子序数为24,则E是铬元素。
(1)非金属性越强,第一电离能越大。但由于氮元素的2p轨道电子是半充满,稳定性强,所以氮元素的第一电离能大于氧元素的。
(2)氨气中心原子氮原子含有1对孤对电子,所以氨气是三角锥形,氮原子是sp3杂化。
(3)CO2是含有极性键的共价化合物,电子式为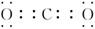 。电子数和原子数都相等的分子是等电子体,所以和CO2互为等电子体的是N2O。
。电子数和原子数都相等的分子是等电子体,所以和CO2互为等电子体的是N2O。
(4)根据构造原理可得铬元素得核外电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1)。因为形成的配合物中含有6个配体,且NH3和水的个数之比是2∶1的,其结构简式为
[Cr(NH3)4(H2O)2]Cl3。
(5)稀硝酸是氧化性酸,氮元素的最低价是-3价,所以反应式为4Mg+10HNO3===4Mg(NO3)2+NH4NO3+3H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
E是某类化妆品生产的常用添加剂(香料),工业上以Y、X为主要原料合成,其中Y的产量可以用来衡量一个国家石油化工发展水平产品,其流程图如下。请完成填空:
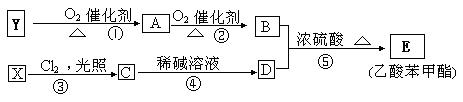
(1) 已知A、B的相对分子质量相差16,则A结构简式为 _
(2) 写出反应⑤的化学反应方程式
(3)E(乙酸苯甲酯)有多种同分异构体,其中属于酯类、且为一取代苯结构的有
种(不包括E本身),任写其中一种的结构简式 。
(4)除图示方法外,请你另设计一种最佳方案由Y制得A(用类似以上流程图表示)
(5)若将反应③、④的条件做如下变动,将先后得到![]() 、
、![]() 而得不到
而得不到![]() 、
、![]() :
:
![]()
已知![]() 与
与![]() 的分子式相同,且
的分子式相同,且![]() 可与
可与![]() 溶液发生显色反应,写出符合条件的由X→
溶液发生显色反应,写出符合条件的由X→![]() (
(![]() 的一硝基代物有2种)的反应方程式_______ 。
的一硝基代物有2种)的反应方程式_______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)已知A、B、C、D、E是短周期的5种元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出B、D元素的名称:B ,D 。
(2)画出C元素的离子结构示意图 。
(3)写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式
(4)A、B、C三种元素形成的化合物为 , 所含的化学键类型为 。
(5)B、C、D三种元素的离子半径由大到小的排列顺序为 (用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省上杭一中高二下学期期末考试化学试卷(带解析) 题型:填空题
(16分。每空格2分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序 。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是 。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a b(填“大于”、“小于”、“等于”)
理由是
| 元素 | Mn | F | |
| 电离能 ( 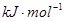 ) ) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | a | b | |
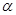 键和
键和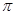 键数目比为 ;
键数目比为 ;| | 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年内蒙古包头33中高一下学期期末考试化学试卷(带解析) 题型:填空题
(16分)已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)写出A的结构简式 。
(2)B、D分子中的官能团分别是 、 。
(3)写出下列反应的反应类型:① ② ④ 。
(4)写出下列反应的化学方程式:
① ;
② ;
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二下学期期末考试化学试卷(解析版) 题型:填空题
(16分。每空格2分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出A、B、C三种元素电负性由大到小的顺序 。
(2)由A、B、C和氢四种元素组成的某种离子晶体,1mol该晶体含有配位键2mol,该晶体的化学式是 。
(3)F和Mn(锰)两元素的部分电离能数据列于下表:预测a b(填“大于”、“小于”、“等于”)
理由是
|
元素 |
Mn |
F |
|
|
电离能 ( |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
a |
b |
(4)AC2分子中 键和
键和 键数目比为
;
键数目比为
;
AC2分子中A原子的杂化方式是 。
(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
|
|
熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
H2S |
187 |
202 |
2.6 |
|
H2C2 |
272 |
423 |
以任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是:
①熔点、沸点差异的主要原因
②在水中的溶解度差异的主要原因
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com