
| A. | 同一周期中,碱金属元素的第一电离能最大 | |
| B. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| C. | 当各轨道处于全满、半满、全空时原子较稳定 | |
| D. | ⅥA族元素的原子,其半径越大,越容易得到电子 |
分析 A.越容易失电子的元素其第一电离能越小;
B.同周期元素中原子半径从左向右逐渐减小;
C.当各轨道处于全满、半满、全空时,能量最低;
D.第VIA族元素的原子,原子半径越大,该元素越不容易得电子.
解答 解:A.越容易失电子的元素其第一电离能越小,同一周期中,碱金属元素最容易失电子,则金属元素第一电离能最小,故A错误;
B.因同周期元素中原子半径从左向右逐渐减小,则同周期元素中ⅦA族元素的原子半径最小,故B错误;
C.当各轨道处于全满、半满、全空时,能量最低,则原子较稳定,故C正确;
D.第VIA族元素的原子,原子半径越大,该元素的原子核对最外层电子吸引力越小,则该元素越不容易得电子,故D错误;
故选C.
点评 本题考查原子结构、元素周期律、电离能等知识点,侧重考查学生对周期表结构、原子结构的掌握及灵活运用元素周期律知识能力,熟练掌握前36号元素原子结构.


科目:高中化学 来源: 题型:多选题
| A. | 戊二醛分子式为C5H10O2,符合此分子式的二元醛有4种 | |
| B. | 戊二醛能在加热条件下和新制备的氢氧化铜反应 | |
| C. | 戊二醛不能使酸性KMnO4溶液褪色 | |
| D. | 2%的GA溶液能破坏菌体蛋白质,杀死微生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,基态原子核外电子排布式1s22s22p63s23p63d24s2.该元素的原子序数为22,该元素是金属元素(填“金属”或“非金属”).
,基态原子核外电子排布式1s22s22p63s23p63d24s2.该元素的原子序数为22,该元素是金属元素(填“金属”或“非金属”).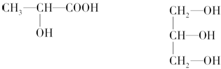
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C. D.
D.
 .
. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠着火时用泡沫灭火器扑灭 | |
| B. | 烧碱溶液保存在带玻璃塞的磨口玻璃试剂瓶中 | |
| C. | 浓硝酸保存在棕色细口试剂瓶中 | |
| D. | 某溶液加入CCl4,CC14层显紫色,证明原溶液中存在I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 配料 | 氯化钠(NaCl)、碘酸钾(KIO3) |
| 含碘量 | 20~40mg•kg-1 |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
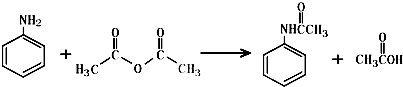
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
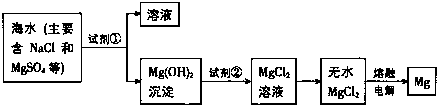
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com