
 (1)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于分子晶体晶体,SeO2中Se原子采取的杂化类型为sp2杂化.
(1)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于分子晶体晶体,SeO2中Se原子采取的杂化类型为sp2杂化.分析 (1)分子晶体的熔、沸点低;根据价层电子对互斥理论确定杂化类型;
(2)①同主族自上而下电负性减小;溴原子序数为35,根据核外电子排布规律书写核外电子排布式,主族元素的最外层电子为价电子;
②根据价层电子对互斥理论确定其分子构型,提供空轨道的原子和提供孤电子对的原子之间形成配位键;
(3)由晶胞图可知,该晶体中原子的堆积方式为面心立方最密堆积,其配位数为12;设其边长为acm,则a2+a2=(4r×10-10)2,V=a3,ρ=$\frac{m}{V}$.
解答 解:(1)SeO2常温下白色晶体,熔点为340-350℃,熔点低,为分子晶体;SeO2分子中Se原子价层电子对=2+$\frac{1}{2}$(6-2×2)=3,Se原子的杂化类型为sp2杂化,
故答案为:分子晶体;sp2杂化;
(2)①同主族自上而下电负性减小,故F的电负性最大,I的电负性最小,Br原子的核外电子排布式为:[Ar]3d104s24p5,最外层7个电子为价电子,所以基态Br原子的价电子排布为4s24p5,
故答案为:I;4s24p5;
②BF3分子中价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3且不含孤电子对,所以该分子是平面三角形结构,化合物BF3•NH3中,B原子提供空轨道的原子、N原子提供孤电子对,所以B、N原子之间形成配位键;
故答案为:平面正三角形;配位键;
(3)由晶胞图可知,该晶体中原子的堆积方式为面心立方最密堆积,其配位数为12;设其边长为acm,则a2+a2=(4r×10-10)2,V=a3=(2$\sqrt{2}$r×10-10)3,晶胞中原子数为$\frac{1}{2}$×6+$\frac{1}{8}$×8=4,晶胞的质量为m=$\frac{4M}{{N}_{A}}$,所以ρ=$\frac{m}{v}$=$\frac{4M}{\frac{{N}_{A}}{(2\sqrt{2}r×1{0}^{-10})^{3}}}$,
故答案为:12;$\frac{4M}{\frac{{N}_{A}}{(2\sqrt{2}r×1{0}^{-10})^{3}}}$.
点评 本题考查物质结构和性质,涉及原子杂化判断、电负性比较、原子核外价电子的书写、晶胞计算等知识点,旨在考查学生对基础知识的掌握,侧重考查分析计算能力及空间想象能力,难点是晶胞计算,题目难度中等.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:解答题
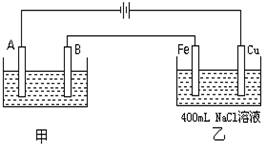 如图为相互串联的甲、乙两个电解池.试回答:
如图为相互串联的甲、乙两个电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
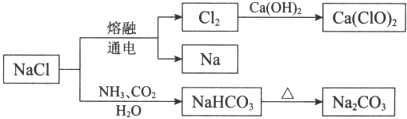
| A. | NaHCO3的热稳定性好 | |
| B. | 如图所示转化涉及的反应都是氧化还原反应 | |
| C. | 常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 | |
| D. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
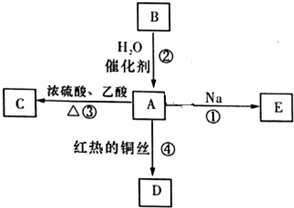 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中是否含有Fe2+:依次加入氯水和KSCN溶液 | |
| B. | pH=2的溶液,可能大量含有:Na+、AlO2-、CO32-、SO32- | |
| C. | 在常温下加入铝粉有氢气放出,则溶液中可能大量含有:K+、Na+、OH-、Cl- | |
| D. | 使紫色石蕊试液变红色的溶液,可能大量含有:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0mol/L | B. | 0.5mol/L | C. | 0.2mol/L | D. | 0.1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com