
【题目】将1.60gCuSO4固体置于下图所示的装置(固定及夹持类仪器未画出)中加热到1100℃,使其分解,分解过程中可以观察到:石英管中固体由白色变为黑色,最终变为红色;BaCl2溶液中生成白色沉淀,品红溶液褪色,集气瓶中收集到无色气体。
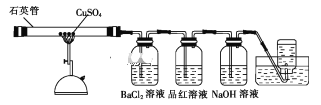
(1)石英主要成分的化学式是_____;高温分解CuSO4固体使用石英管而不使用普通玻璃管的原因是_____。
(2)石英管中剩余红色固体质量为0.72 g,经检测为不含硫元素的纯净物。则该固体的化学式为__。
(3)将BaCl2溶液中生成的白色沉淀过滤并洗涤,向洗涤后的沉淀中加入稀盐酸,无明显现象。
①沉淀的化学式为_____。
②检验沉淀是否洗净的方法是___。
(4)若NaOH溶液足量,则其中发生反应的离子方程式为____。
(5)集气瓶中收集的无色气体是____(填化学式),检验该气体的方法是___。
【答案】SiO2 石英熔点高,耐高温,普通玻璃不耐高温 Cu2O BaSO4 取最后得到的洗涤液,向其中加入硝酸酸化的硝酸银溶液,若无沉淀生成,则沉淀已洗净,若有白色沉淀生成,则沉淀未洗净 SO2+2OH-![]() SO32-+H2O O2 将带火星的木条伸入瓶中,木条复燃
SO32-+H2O O2 将带火星的木条伸入瓶中,木条复燃
【解析】
硫酸铜加热到1100℃发生分解反应,石英管中固体由白色变为黑色,说明生成了氧化铜;最终变为红色,说明氧化铜受热分解生成了氧化亚铜;BaCl2溶液中生成白色沉淀,说明生成了硫酸钡沉淀,从而说明生成了三氧化硫;品红溶液褪色,说明生成了二氧化硫;集气瓶中收集到无色气体,可能为氧气,据此答题。
(1)石英的主要成分是二氧化硅,化学式是SiO2,高温分解CuSO4固体使用石英管而不使用普通玻璃管的原因是石英是原子晶体,熔点高,耐高温,而普通玻璃不耐高温,故答案为:SiO2;石英熔点高,耐高温,普通玻璃不耐高温。
(2)石英管中剩余红色固体质量为0.72g,经检测为不含硫元素的纯净物,则为铜的氧化物,1.60gCuSO4中Cu的质量为1.60g×![]() =0.64g,物质的量为
=0.64g,物质的量为![]() =0.01mol,则氧元素的质量为0.72g-0.64g=0.08g,物质的量为
=0.01mol,则氧元素的质量为0.72g-0.64g=0.08g,物质的量为![]() =0.005mol,则Cu和O的物质的量之比为:Cu:O=0.01mol:0.005mol=2:1,该固体的化学式为Cu2O,故答案为:Cu2O。
=0.005mol,则Cu和O的物质的量之比为:Cu:O=0.01mol:0.005mol=2:1,该固体的化学式为Cu2O,故答案为:Cu2O。
(3)①将BaCl2溶液中生成的白色沉淀过滤并洗涤,向洗涤后的沉淀中加入稀盐酸,无明显现象,说明该沉淀为BaSO4,故答案为:BaSO4。
②检验该沉淀是否洗净,就是检验其表面是否含有氯离子,检验氯离子的方法为:加入硝酸酸化的硝酸银溶液,若无沉淀生成,则沉淀已洗净,若有白色沉淀生成,则沉淀未洗净,故答案为:取最后得到的洗涤液,向其中加入硝酸酸化的硝酸银溶液,若无沉淀生成,则沉淀已洗净,若有白色沉淀生成,则沉淀未洗净。
(4)若NaOH溶液足量,则SO2与过量的氢氧化钠反应生成亚硫酸钠和水,离子方程式为:SO2+2OH-=SO32-+H2O,故答案为:SO2+2OH-=SO32-+H2O。
(5)由分析可知集气瓶中收集的无色气体是氧气,检验氧气的方法是用带火星的木条伸入瓶中,看木条是否复燃,故答案为:O2;将带火星的木条伸入瓶中,木条复燃。


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】(16分)下图中的实验装置可用于制取乙炔。请填空:

(1)图中,A管的作用是 。
制取乙炔的化学方程式是 。
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 ,乙炔发生了 反应。
(3)乙炔通入溴的CCl4溶液中观察到的现象是 ,乙炔发生了 反应。
(4)为了安全,点燃乙炔前应 ,乙炔燃烧时的实验现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是短周期元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,Y和Z相邻,Z原子的最外层电子数是次外层电子数的三倍,则
(1)写出下列元素名称:X是_____,Z是_____.Y在周期表中第____周期,第_____族。
(2)由Y和Z组成,且Y和Z的质量比为7:20的化合物的分子式是______.
(3)写出由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种阴、阳离子______和______。
(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子个数比为4:2:3,该盐的化学式是______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。

(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_____________________________________。
(2)上述生产流程中溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为______________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强碱性的无色透明溶液中,能大量共存的离子组是( )
A.K+、Na+、SO42-、CO32-B.Mg2+、NH4+、NO3-、Cl-
C.Ba2+、K+、Cu2+、Cl-D.Na+、Ag+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在废水处理、粗盐提纯等过程中通常会涉及离子检验、除杂等过程。
(1)某工厂废水只含Na+、K+、Cu2+、Ba2+、Mg2+、OH-、CO32-中的若干种。实验小组对废水进行了检测:
步骤1:对废水进行观察,废水为无色澄清液体。
步骤2:取少量废水,向水样中加入过量BaCl2溶液,有白色沉淀生成,静置。
步骤3:取少量步骤2所得上层清液,向其中滴加酚酞,溶液变红。
①由步骤1可得的结论是____。
②步骤2中所发生反应的离子方程式为___。
③实验中不能确定是否存在的离子是____。
④请设计实验方案对溶液中还未能确定的离子进行检测,方法是:___。
(2)某粗盐溶液经检测其中含有的杂质离子是Ca2+、Mg2+、Br-、SO42-。实验小组经过下列实验过程最终获得NaCl晶体:
步骤1:向溶液中加入试剂除去Ca2+、Mg2+和SO42-,过滤,向滤液中加入盐酸至无气泡产生。
步骤2:向步骤1所得溶液中通入适量的气体X,充分反应后加入CCl4,振荡后分液。
步骤3:将步骤2所得水层蒸发结晶。
①按使用顺序写出步骤1所用试剂的化学式:_____。
②步骤2中发生反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用莫尔盐[化学式为(NH4)xFe(SO4)2·6H2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100 mL溶液。
②量取10.00 mL KMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积为20.00 mL。所发生反应的离子方程式如下:H++Fe2++MnO4-![]() Fe3++Mn2++H2O(未配平)
Fe3++Mn2++H2O(未配平)
(1)(NH4)xFe(SO4)2·6H2O中x=____,溶液中c(Fe2+)=___mol·L-1。
(2)第①步实验中所需的玻璃仪器除量筒、烧杯、胶头滴管外,还有___。
(3)由第②步实验的反应可知还原性:Fe2+___(填“>”或“<”)Mn2+。
(4)计算KMnO4溶液的物质的量浓度,写出计算过程。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W、X、Y、Z原子的最外层电子数之和为21,下列说法中不正确的是

A. 原子半径:X>Y>W
B. 简单阴离子的还原性:Z>W
C. 气态氢化物的稳定性:W>Y
D. 氧化物对应水化物的酸性:Z>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C 的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。请回答下列问题.(题中的字母只代表元素代号,与实际元素符号无关):
(1)B的元素符号为_________,E在元素周期表中的位置为__________;
(2)A、C、D三种元素组成的一种常见化合物,是氯碱工业的重要的产品,请写出该反应的化学方程式___________。
(3)A2C和A2E两种物质沸点较高的是_______(填写化学式)。
(4)B与F两种元素形成的一种化合物分子,各原子均达8 电子结构,则该化合物化学式为____。B和F两种元素还能形成另一种化合物,其中B显最高正价,该化合物能与水反应生成两种酸,请写出该化合物与水反应的化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com