
����Ŀ����ͼΪʵ����ijŨ�����Լ�ƿ��ǩ�ϵ�������ݣ��ݴ˻ش��й����⣺

��1����Ũ�������ʵ���Ũ��Ϊ________________��
��2��ȡ����������ĸ�Ũ����ʱ�������������в�����ȡ����Ķ��ٶ��仯����_________(����ĸ���)��
a����Һ��H2SO4�����ʵ��� b����Һ��Ũ�� c����Һ���ܶ�
��3��ijͬѧ��������Ũ���������ˮ����500mL0.400mol��L��1��ϡ���ᡣ�ṩ�������У���ͷ�ιܡ����������ձ�����Ͳ��ϸ���Լ�ƿ��
������ϡ����ʱ����ȱ�ٵ�������_______________(д����)���������ϱ���_____(����ĸ���)��
a���¶� b��Ũ�� c������ d��ѹǿ e���̶���
�ڸ�ѧ����Ҫ��ȡ_________mL����Ũ����������ơ�
�������ƹ����У�����ʵ������������Ƶ�ϡ��������ʵ���Ũ���к�Ӱ�죿 (�ں�������д��ƫ��������ƫС��������Ӱ����)����Ͳ��ȡŨ����ʱ���ӹ۲찼Һ��__________________�����ݡ�ҡ�Ⱥ��ã�Һ����ڿ̶��ߣ�������ˮ���̶���________________��
���𰸡�18.4mol��L��1 bc 500mL����ƿ ace 10.9 ƫС ƫС
��������
��1������c=![]() ���㣻
���㣻
��2��������ȡ��Һ��Ũ�Ȳ�������жϣ�
��3���ٸ�������һ�����ʵ���Ũ�ȵ���Һ�IJ����ҳ�����Ҫ������
�ڸ���c1V1=c2V2�ɼ��㣻
�۸���c=![]() �ж�������Һ��Ũ����
�ж�������Һ��Ũ����
��1��Ũ��������ʵ���Ũ��c=![]() =18.4mol/L��
=18.4mol/L��
��2��a����Һ����������ʵ���=nV����������Һ������йأ�ѡ��a��ѡ��
b����Һ��Ũ��=c=![]() ������Һ������أ�ѡ��bѡ��
������Һ������أ�ѡ��bѡ��
c����Һ���ܶ�����Һ������أ�ѡ��cѡ��
��ѡbc��
��3��������500mL0.400mol��L��1��������Һ�����Ƹ���Һ�IJ����ǣ��������ܽ⡢��ȴ��ת�ơ�ϴ�ӡ�ת�ơ����ݡ�ҡ�ȣ����ƹ�������Ҫʹ�õ�����Ϊ��ҩ�ס�������ƽ���ձ�����������500mL����ƿ����ͷ�ιܣ����Ի�ȱ�ٵ�����Ϊ��500mL����ƿ���������ϱ����¶ȡ��������̶��ߣ���ѡace��
�ڸ���c1V1=c2V2��֪18.4mol��L��1��V1=0.5L��0.400mol��L��1�����V1=0.0109L=10.9mL��
������Ͳ��ȡŨ����ʱ���Ӱ�Һ�棬��ȡ��Ũ����ƫ�٣����ʵ����ʵ���ƫС����Һ��Ũ��ƫС��
���ݺ���ҡ�ȡ����ã�����Һ���½����ټ�����������ˮ��������Һ�����ƫ����Һ��Ũ��ƫС��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ϊ�ı�δ�������ʮ���¿Ƽ�֮һ��ȼ�ϵ�ؾ�������Ⱦ������������Ч�ʵ��ص㡣��ͼ��ʾΪ����ȼ�ϵ�صĽṹʾ��ͼ���������ҺΪKOH��Һ���缫����Ϊ���ɶ��ʯī�����������������ֱ��������ϵش�����������ͨ��ȼ�ϵ��ʱ������ڱպϻ�·�в��ϵز����������Իش��������⣺
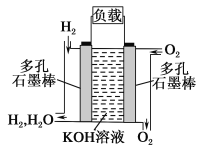
��1��ͼ��ͨ�����صĵ�����������Ϊ________(��������ҡ�)��
��2��д������ȼ�ϵ�ع���ʱ�ĵ缫��Ӧ���ܷ�Ӧ��
������_____________________________________��
�ܷ�Ӧ��____________________________________��
��3��Ϊ�˻�����������˳������̫�����⣬��ҵ������ʯ�Ͳ�Ʒ��ˮ�ڴ�����������ȡ������д��C3H8��H2O��Ӧ����H2��CO��ѧ����ʽ____________________________��
��4��������ȼ�ϵ�ظ�Ϊ����������ȼ�ϵ�أ��õ�ع���ʱ�ĸ�����ӦΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������� A �� NaH ������Ҫ�Ļ�ԭ������ˮ��ǿ�ҷ�Ӧ��һ�������£�2.4g NaH ������ B ��Ӧ���� 3.9g ������ A �� 2.24L��������ɱ�״������ H2����֪���� B ��ʹʪ���ɫʯ����ֽ��������ش��������⣺
��1��B �Ļ�ѧʽ��_____��
��2��NaH ������ B ��Ӧ���ɻ����� A �Ļ�ѧ����ʽ_____���÷�Ӧ�� A ��_____��
A.�������� B.��ԭ���� C.�Ȳ�����������Ҳ���ǻ�ԭ����
��3��0.1molA ���������ᷢ����������ԭ��Ӧ������� HCl_____mol
��4���ڸ������⻯�ƣ�NaH���ɽ����Ȼ��ѣ�TiC14����ԭ�ɽ����ѣ�ͬʱ�õ�������壬 �����ƽ��Ħ������Ϊ 25 g/mol��д���÷�Ӧ�Ļ�ѧ����ʽ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɫ��������A������KCl��CaCO3��Na2CO3��Na2SiO3��CuSO4�еļ��֣����³�ѹ�½�������ʵ�顣
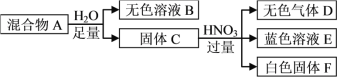
�����ƶ�����ȷ����
A. ��ɫ��ҺB��pH��7
B. ��ɫ����F����Ҫ�ɷ���H2SiO3
C. �����A����Na2SiO3��CuSO4��CaCO3
D. ����ɫ��ҺB�м�HNO3�ữ���������ٵμ�AgNO3�����а�ɫ�������ɣ�˵�������A����KCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������̼����ȼ�ϵ��ԭ��ʾ����ͼ�������йظõ�ص�˵����ȷ����
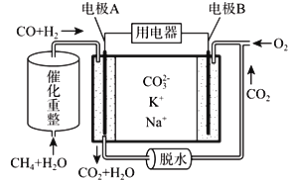
A. ��ӦCH4+H2O![]() 3H2+CO����1mol CH4ת��4mol����
3H2+CO����1mol CH4ת��4mol����
B. �缫A��H2����ĵ缫��ӦΪ��H2+2OH--2e-=2H2O
C. ��ع���ʱ��CO32-��缫B�ƶ�
D. �缫B�Ϸ����ĵ缫��ӦΪ��O2+2CO2+4e-=2CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ����գ�
��1��д����ͼ�л��������_____________
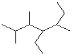
��2���ٵ����ʵ����������л���A������B����ϩC����ȲD�����ֱ�����������ȫȼ�գ���ҪO2������___________(����ĸ��д����ͬ)�������������������л���ֱ�����������ȫȼ�գ���ҪO2������________��
�����и����л���������Ȼ�ϣ��������ʵ���һ��������ȫȼ��ʱ����ˮ����
�������������������������___________
A��C3H8��C4H6 B��C3H6��C4H6O2 C��C2H2��C6H6 D��CH4O��C4H4O5
��3��ij���������������ӳɺ�õ�����ΪCH3CH2CH2CH(CH3)2����������ǵ�ϩ��������ܵĽṹ��ʽ��_____�֣����������Ȳ��������ܵĽṹ��ʽΪ_________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����մ�Na2S2O35H2O�����մ��С�մ�Ϊ�մ����ֵܣ������������������й㷺��Ӧ�á�
��1����ҵ�ϣ���̼���ƺ����������ʵ���1:2��������Һ����ͨ��SO2����ȡNa2S2O3��ͬʱ�ų�CO2��д���˷�Ӧ�Ļ�ѧ��Ӧ����ʽ___��������Һ�ڿ����о��û���ֵ���ɫ���ʣ����ⶨ�����ʾ���������������ƵĽṹ�������ʵĵ���ʽΪ��___��
��2��Na2S2O3����Һ�����ڵζ�I2�ĺ��������ζ���Һ�����Իᵼ�²ⶨ���ƫ�ߣ������ӷ���ʽ������ԭ��____��
��3����ҵ�ϳ��ô��մ���Һ���չ�ҵβ���е�Cl2������������ΪSO42-����д�������ӷ���ʽ��___��������һ���Լ����Լ��÷�Ӧ�Ƿ��ѷ�����Ӧ����___��
A.AgNO3+HNO3(ϡ) B.BaCl2+HCl C.Ʒ��+H2SO4(ϡ) D.HCl+����ʯ��ˮ
��4�����ܱ�������Ͷ��һ������Na2O2��NaHCO3��300���³�ַ�Ӧ������������Ϊ���������ʼʱn(NaHCO3)/n(Na2O2)�������������Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ������������⣺
(1)���ĵ���ʽ_________________
(2)��ʯ���Ľṹʽ_______________
(3)��Է�������Ϊ72�ҷе���͵������Ľṹ��ʽ____________
(4)��2����ϩ�Ľṹ��ʽ___________________________
(5)��H2�ӳ�����2��5�����������Ȳ����ϵͳ����_________________
(6)![]() ��ϵͳ����__________________________
��ϵͳ����__________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������̬����ɵĻ������Ϊ10ml���������������ٳ��ȼ�գ���������ͨ��ŨH2SO4�����������15ml����ͨ����ʯ����������ּ���20ml [���������Ϊͬ�£�120�棩ͬѹ��101kPa��]�����������ɿ���Ϊ( )
A. C2H6��C2H4 B. C2H4��C2H2 C. CH4��C3H4 D. C4H10��C2H4[��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com