
分析 (1)所含元素化合价降低的反应物为氧化剂,所含元素化合价升降的反应物为还原剂,据此结合元素化合价判断;
(2)二氧化氮和一氧化碳经过排气管中的催化转化器转化为对大气无污染的物质,应生成氮气、二氧化碳;
(3)n(NO2)=$\frac{13.44L}{22.4L/mol}$=0.6mol,结合方程式计算.
解答 解:(1)在反应①中,NO2中N元素化合价降低,被还原,化合价由+4价降低到+3价,则NO2为氧化剂,NO中N元素化合价升高,被氧化,NO为还原剂,
在反应②中,只有N元素化合价发生变化,N元素化合价分别由+4价升高到+5价、降低到+3价,NO2既是氧化剂又是还原剂,
故答案为:NO2;NO;NO2;NO2;
(2)二氧化氮和一氧化碳经过排气管中的催化转化器转化为对大气无污染的物质,应生成氮气、二氧化碳,反应方程式为:2NO2+4CO$\frac{\underline{\;催化剂\;}}{\;}$N2+4CO2,
故答案为:2NO2+4CO$\frac{\underline{\;催化剂\;}}{\;}$N2+4CO2;
(3)n(NO2)=$\frac{13.44L}{22.4L/mol}$=0.6mol,由方程式可知消耗0.8molNH3,m(NH3)=0.8mol×17g/mol=13.6g,故答案为:13.6.
点评 本题以氮的氧化物的性质为载体综合考查化学方程式的有关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意能正确书写方程式是解本题关键,难度不大.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
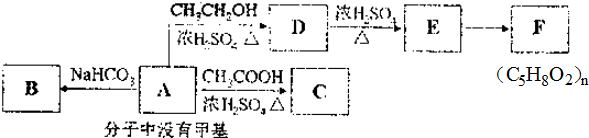
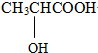 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
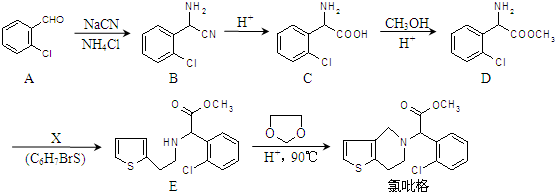
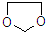 在酸性条件下生成氯吡格雷和另一种常见有机物,该有机物在浓硫酸催化下,加热脱水生成乙炔,试写出该有机物脱水生成乙炔的方程式.CH2OHCH2OH$→_{△}^{浓H_{2}SO_{4}}$CH≡CH↑+2H2O
在酸性条件下生成氯吡格雷和另一种常见有机物,该有机物在浓硫酸催化下,加热脱水生成乙炔,试写出该有机物脱水生成乙炔的方程式.CH2OHCH2OH$→_{△}^{浓H_{2}SO_{4}}$CH≡CH↑+2H2O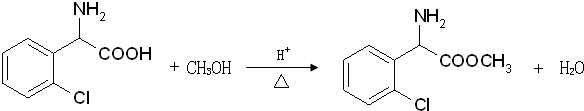
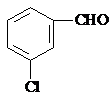 、
、 、
、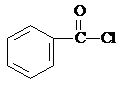 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z为0.3 mol•L-1 | B. | Y2为0.4 mol•L-1 | C. | X2为0.2 mol•L-1 | D. | Z为0.4 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
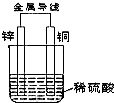 根据如图铜锌原电池示意图,回答下列问题:
根据如图铜锌原电池示意图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有碳碳双键的有机物都属于烯烃 | |
| B. | 一氯甲烷、二氯甲烷、三氯甲烷与四氯甲烷互为同系物 | |
| C. | 两种烃的含碳量相同,则一定互为同分异构体 | |
| D. | 苯酚与苯甲醇都属于烃的含氧衍生物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的晶体一定具有高的熔、沸点及硬度 | |
| B. | 晶格能由大到小:NaI>NaBr>NaCl>NaF | |
| C. | 含阳离子的化合物一定有阴离子 | |
| D. | 空间利用率:面心立方>六方密堆积>体心立方 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com