
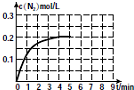
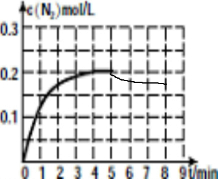
 研究化学反应,不仅要关注反应的速率、方向性,还要关注反应进行的限度以及反应过程中的能量变化.
研究化学反应,不仅要关注反应的速率、方向性,还要关注反应进行的限度以及反应过程中的能量变化.| 0 | 1min | 2min | 4min | 5min | |
| 130℃ | 0.50mol | 0.35mol | 0.25mol | 0.10mol | 0.10mol |
| 180℃ | 0.50mol | 0.30mol | 0.18mol | 0.15mol |
| c2(N2)?c2(H2O) |
| c2(NH3)?c(NO)?c(NO2) |
| △C |
| △t |
| 0.25mol/L |
| 2L |
 ,
, ;
;| c2(N2)?c2(H2O) |
| c2(NH3)?c(NO)?c(NO2) |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
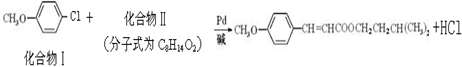

查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
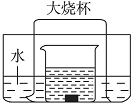 如图所示的实验装置,向盛有足量水的水槽里放两个烧杯,小烧杯里放有适量的铜片和过量的浓硝酸,小烧杯外面倒扣一个大烧杯,请回答下列问题:
如图所示的实验装置,向盛有足量水的水槽里放两个烧杯,小烧杯里放有适量的铜片和过量的浓硝酸,小烧杯外面倒扣一个大烧杯,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
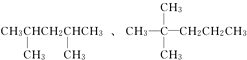
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③④⑤ | B、①②④ |
| C、①②③④ | D、①②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com