
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色实验均为黄色。

请填写下列空白:
(1)写出下列化学式:A____________,D____________
(2)以上反应中,不属于氧化还原反应的有________________(填序号)。
(3)完成方程式
①A→C反应的离子方程式:______________________________________________,
②B→D反应的化学方程式:______________________________________________________。
【答案】Na Na2CO3 ⑤⑥ 2Na+2H2O=2Na++2OH—+H2↑ 2Na2O2+2CO2=2Na2CO3+O2
【解析】
A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色实验均为黄色,则A是Na;钠与氧气反应生成B,B是Na2O2,Na2O2与二氧化碳反应生成Na2CO3,D是Na2CO3;钠与水反应生成NaOH,C是NaOH;NaOH与过量二氧化碳反应生成NaHCO3,E是NaHCO3。
(1)根据以上分析,A是Na,D是Na2CO3;
(2)没有化合价变化的反应是非氧化还原反应,以上反应中,NaOH与过量二氧化碳反应生成NaHCO3、碳酸氢钠加热分解为碳酸钠、二氧化碳、水,没有化合价变化,不属于氧化还原反应,填⑤⑥。
(3)①A→C是钠与水反应生成氢氧化钠和氢气,反应的离子方程式是2Na+2H2O=2Na++2OH—+H2↑;
②B→D是过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度下,分别向10.00mL0.1mol/L的KCl和K2CrO4溶液中滴加0.1mol/LAgNO3溶液,滴加过程中-lgc(M)(M为Cl-或CrO42-)与AgNO3溶液体积(V)的变化关系如图所示(忽略溶液体积变化)。下列说法不正确的是( )
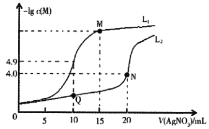
A.曲线L1表示-lgc(Cl-)与V(AgNO3)的变化关系
B.M点溶液中:c(NO3-)>c(K+)>c(Ag+)>c(H+)>c(OH-)
C.该温度下,Ksp(Ag2CrO4)=4.0×10-12
D.相同实验条件下,若改为0.05mol/L的KCl和K2CrO4溶液,则曲线L2中N点移到Q点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝色 | 有无色气泡产生 |
以下结论不正确的是
A.Ⅰ中无明显变化,说明两溶液不反应B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中的化学方程式为2HCl+Zn=ZnCl2+H2↑D.Ⅲ中发生的反应是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) 。已知反应过程中某一时刻,SO2、O2、SO3分别是2mol/L、1mol/L、2mol/L,当反应达到平衡时,可能存在的数据是( )
2SO3(g) 。已知反应过程中某一时刻,SO2、O2、SO3分别是2mol/L、1mol/L、2mol/L,当反应达到平衡时,可能存在的数据是( )
A.SO2为4mol/L,O2为2mol/LB.SO2为2.5mol/L
C.SO2、SO3均为1.5mol/LD.SO3为4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】启普发生器是荷兰科学家设计的实验室气体发生装置,由图中漏斗1和容器2两部分构成;现借助启普发生器及相关装置模拟侯氏制碱法制备日用化学品——NH4Cl和Na2CO3。回答相关问题:
(NaHCO3的制备)
反应原理:NH3+NaCl+CO2+H2O=NH4Cl+NaHCO3↓
反应装置:

(1)启普发生器中发生的离子反应方程式为___,如果上述装置中导管被堵塞,启普发生器中观察到的现象是___。
(2)仪器3中盛装的试剂是___;已知常温,NaCl的溶解度为35.9g,仪器4中含氨的饱和食盐水的配制方法是将20.0mL浓氨水与8.0gNaCl混合振荡过滤,试推测过滤除去的物质为___。
(3)观察仪器4中CO2流速的方法是___,仪器5中试剂的作用是___。
(4)反应结束后,对仪器4进行冷却并趁冷过滤其中的悬浊液,“趁冷”的目的是___。
(Na2CO3的制备)
(5)将(4)所得固体转移至蒸发皿中加热得到Na2CO3;请设计简单实验证明NaHCO3固体已分解完全___。
(NH4Cl的制备)
(6)向(4)所得母液中加入两种物质并降温,NH4Cl会逐步结晶析出,所加物质的名称是___,过滤NH4Cl晶体后的滤液可以再次循环使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中正确的是
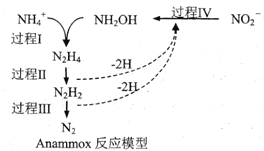
A.1molNH4+所含的质子总数为10NA(设NA为阿伏加德罗常数的值)
B.该方法每处理1molNH4+,需要0.5molNO2-
C.过程IV中,NO2-发生氧化反应
D.N2H2中含有σ键和π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2A(g)B(g)。分别取1molA于2L的固定体积的容器中,分别在T1和T2下,测得A的转化率随时间变化的关系曲线如图所示。下列说法正确的是
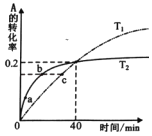
A.升高温度可缩短反应到达平衡的时间同时能提高A平衡的转化率
B.从反应开始至40min时,T2温度下生成B的物质的量比T1温度下多
C.图中a、b、c三点的化学反应速率依次减小
D.用B表示T1温度下前40min的平均反应速率:v(B)=0.0025molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。
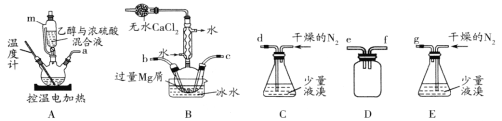
已知:①乙醚的熔点为-116.3℃,沸点为34.6℃。
②Mg和Br2反应非常剧烈,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
③不考虑氮气与镁的反应
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,使溴分子缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤,将滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
请回答下列问题:
(1)装置A中使用仪器m的优点是_______;
(2)步骤I中所选装置的正确连接顺序是a _____(填小写字母),装置D的作用是____;
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是________;
(4)实验中不能用干燥空气代替干燥N2,原因是___________;
(5)有关步骤V的说法,正确的是____;
A 可用95%的乙醇代替苯溶解粗品 B 洗涤晶体可选用0℃的苯
C 加热至160℃的主要目的是除去苯 D 该步骤的目的是除去乙醚和可能残留的溴
(6)为测定产品的纯度(假定杂质不参与反应),可用EDTA (简写为Y4-,无色)标准溶液滴定,以络黑T为指示剂(pH=6.3~11.6时显蓝色,pH>11.6时显橙色)。已知: Mg2+与络黑T形成的配合物(Mg2+-络黑T)呈酒红色,Mg2+与Y4-形成的MgY2-为无色;在pH约为9的缓冲溶液中滴定,反应的离子方程式为:Mg2+ + Y4-=MgY2-,Mg2+-络黑T+Y4- =MgY2- +络黑T。
①判断滴定终点的现象为____________________;
②测定前,先称取0.2500g无水MgBr2产品,溶解后,加人2滴络黑T试液作指示剂,用0.0500 mol·L-1 EDTA标准溶液滴定至终点,消耗EDTA标准溶液25.00 mL,则测得无水MgBr2产品的纯度是___(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇水蒸气催化重整反应是生产氢能的有效方法之一。
(1)甲醇水蒸气重整制氢存在以下副反应:(已知a、b均大于零)
Ⅰ:甲醇分解 :CH3OH(g) CO(g)+2H2(g) △H= +akJ·mol-1
Ⅱ:水蒸气变换:CO(g)+H2O(g)CO2(g)+ H2(g) △H= ![]() kJ·mol-1
kJ·mol-1
催化重整反应:CH3OH(g) +H2O(g)CO2(g)+ 3H2(g) △H=________kJ·mol-1
(2)甲醇分解与水蒸气变换反应Kp与温度关系见下表:
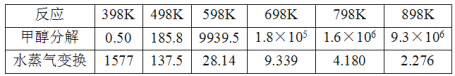
①698K时.CH3OH(g) +H2O(g)CO2(g)+ 3H2(g)的Kp=___________。(保留小数点后二位)
②在较高温度下进行该反应.发现平衡时体系中CO含量偏高的原因是_____________。
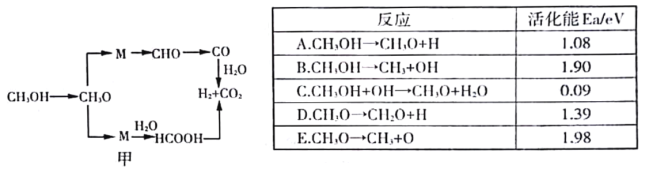
(3)甲醇水蒸气重整反应的可能机理如图甲所示.结合下表分析CH3OH →CH3O的主要反应为______________(填序号),解释原因______________________________________________________________。
(4)某研究小组对重整反应温度(T)与水醇比(![]() )进行优化,得到图乙、丙。
)进行优化,得到图乙、丙。
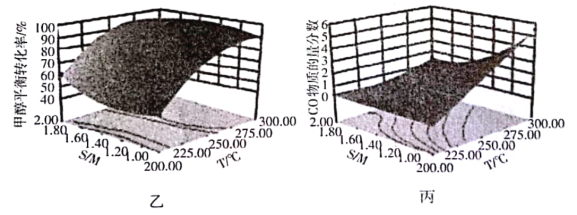
结合图乙分析温度、水醇比与甲醇平衡转化率的关系:________________.
②在图中用阴影画出最优化的反应条件区域(下图为乙和丙组合的平面图,实线为甲醇平衡转化率,虚线为CO物质的量分数):______________
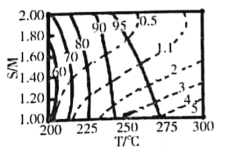
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com