
| A. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 | |
| B. | 两清液混合,AgCl和AgI都沉淀 | |
| C. | 若取0.1435 g AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01 mol/L | |
| D. | 向AgI清液加入AgNO3,c(Ag+)增大,Ksp(AgI)也增大 |
分析 饱和的AgCl溶液中:c(Ag+)=c(Cl-)=1.342×10-5,饱和的AgI溶液中:c(Ag+)=c(I-)=1.0×10-8,等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6,溶液中c(Cl-)>c(I-),以此解答该题.
解答 解:饱和的AgCl溶液中:c(Ag+)=c(Cl-)=1.342×10-5,饱和的AgI溶液中:c(Ag+)=c(I-)=1.0×10-8,等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6,
A.由于c(Cl-)》c(I-),若AgNO3固体足量,沉淀以AgCl为主,故A正确;
B.等体积混合后,浓度减半,c(Cl-)=6.71×10-6,c(I-)=5.0×10-9,c(Ag+)=6.71×10-6,明显,混合后,AgI必然沉淀,AgCl则不然,故B错误;
C.常温下,氯化银的溶解度为:1.342×10-5×143.5═0.00192(g),c(Cl-)═1.342×10-5mol/L,0.1435克AgCl只有少量溶解,故c(Cl-)═1.342×10-5mol/L,故C错误;
D.Ksp与温度有关,温度不变,Ksp不变,故D错误.
故选A.
点评 本题考查难溶电解质的生成,为高频考点,把握AgI更难溶且碘离子浓度小为解答的关键,侧重分析与应用能力的考查,注意沉淀生成的判断,题目难度不大.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素原子电子层数增大 | |
| B. | 元素原子最外层电子数呈现周期性变化 | |
| C. | 元素的化合价呈现周期性变化 | |
| D. | 核电荷数依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5(b-2a)mol/L | B. | 5(b-2a)mol/L | C. | 0.5(b-a)mol/L | D. | 10(b-2a)mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的Cu2O为1.44 g | |
| B. | 做氧化剂的硝酸为0.14 mol | |
| C. | 至少需0.5 moI/L硝酸140 mL与Cu2O反应 | |
| D. | 转移的电子总数为0.06 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂被还原,还原剂被氧化 | |
| B. | 有单质参加或生成的反应一定属于氧化还原反应 | |
| C. | 失电子难的物质,获得电子的能力一定强 | |
| D. | 一种元素被氧化,肯定有另一种元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中Cu2+浓度增大 | B. | 溶液中Cu2+数目减少 | ||
| C. | 该溶液的pH减小 | D. | 溶液的蓝色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
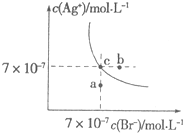 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点 | |
| C. | 图中a点对应的是AgBr的不饱和溶液 | |
| D. | 向组成为c点的溶液中加入等体积的0.1 mol/L的氯化钠溶液,可产生AgCl沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
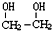 )是一种重要的化工原料,
)是一种重要的化工原料, (g)△H=a kJ/mol
(g)△H=a kJ/mol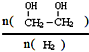 增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)
增大的措施有降温、加压、增加CO的浓度或及时将乙二醇从混合物中分离出来(写两条)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com