
现有CuO和Fe2O3的混合物a g,向其中加入1 mol·L-1的HNO3溶液200 mL恰好完全反应,若将2a g该混合物用足量CO还原,
充分反应后剩余固体质量为
A.(2a-1.6)g B.2(a-1.6)g C.(a-1.6)g D.3.2 g
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
从海水中提取镁的工艺流程图可表示如下:
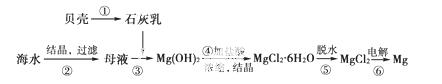
下列说法不正确的是
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2时阴极产生氯气
C.步骤⑤,可将晶体置于HCl气体氛围中脱水
D.上述工艺流程中涉及到化合、分解和复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
向FeI2溶液中滴加适量氯水,将反应后溶液分3份,甲试管中滴加淀粉溶液,乙试管滴加KSCN溶液,丙试管中滴加酸性高锰酸钾溶液,下列说法正确的是
A.若甲试管溶液呈蓝色,则乙试管溶液一定呈血红色
B.若甲试管溶液呈蓝色,则乙试管溶液可能无明显现象
C.乙试管溶液呈血红色,则甲试管溶液不可能呈蓝色
D.甲试管溶液呈蓝色,丙试管中紫红色褪去,说明滴加氯水后的溶液中一定
存在Fe3+和Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离平衡曲线如图所示:
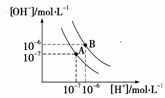
A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡到达B点。
(1)25℃时水的离子积为________________,100℃时水的离子积为________________。
(2)100℃时,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
下面三种方法均可制得Fe(OH)2白色沉淀。
方法一:用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需要加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
 (3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
(3)生成Fe(OH)2白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
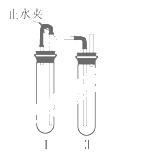
方法二:在如右图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试 管Ⅰ里加入的试剂是 。
管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得Fe(OH)2白色沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,
塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,
理由是 。
方法三:利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如右图所示,已知两电极的材料分别为石墨和铁。
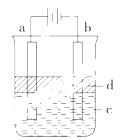 (1)a电极的
(1)a电极的 材料应为 ,电极反应式为 。
材料应为 ,电极反应式为 。
(2)电解液c可以是 (填编号)。
A.纯水 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是 ,在加入苯之前对电解液c
应作何简单处理? 。
(4)为了在较短时间内看到白色沉淀,可采取的措施是 (填编号)。
A.改用稀H2SO4作电解液 B.适当增大电源的电压
C.适当减小两极间的距离 D.适当降低电解液的温度
(5)若c用Na2SO4溶液,当电解一段时间后看到白色Fe(OH)2沉淀,再反接电源电解,除了电极上看到气泡外,另一明显现象为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示物质间的相互转变关系,反应①在工业上可用来生产化 合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下,D、E、G均是
合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下,D、E、G均是 气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%.
气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%.

请回答下列问题:
(1)写出F的化学式:________________.
(2)写出G的电子式:________________.
(3)反应①的化学方程式为___________________,人们将反应①涉及的化学工业称为________.
(4)反应⑤的离子方程式为______________________________________________.
高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为:
①Na2FeO4具有强 氧化性可杀菌消毒;
氧化性可杀菌消毒;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列不属于电离方程式的是( )
A.2H2O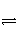
 H3O++OH-
H3O++OH-
B.H2O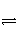
 H++OH-
H++OH-
C.CH3COOH+H2O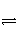
 CH3COO-+H3O+
CH3COO-+H3O+
D.CH3COOH+NaOH===CH3COONa+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com