
科目:高中化学 来源: 题型:选择题
| A. | 常温下能够使pH试纸显红色的溶液 | B. | 常温下能够使甲基橙显黄色的溶液 | ||
| C. | [OH-]>[H+]的溶液 | D. | 加入MgCl2生成白色沉淀的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
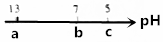
| A. | NaCl溶液 | B. | NaOH溶液 | C. | CH3COOK溶液 | D. | NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠与足量的CO2气体反应转移1mole-时增重的质量为28g | |
| B. | 碳酸钠的碱性较弱,可用作治疗胃酸过多的药物 | |
| C. | 生活中的“高钙牛奶”、“加铁酱油”中的钙和铁指的是钙离子和亚铁离子 | |
| D. | 氯化铝坩埚可用来熔融碳酸钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定量Cl2通入FeBr2溶液中:5Cl2+4Fe2++6Br-═10Cl-+4Fe3++2Br2 | |
| B. | 过量CO2通入NaAlO2溶液中:CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32- | |
| C. | 在溶液中NH4HSO3于NaOH等物质的量混合:NH4++HSO3-+2OH-═SO32-+NH3↑+2H2O | |
| D. | Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式 | 结构简式 | 外观 | 熔点 | 溶解性 |
| C12H10ClN3O |  | 白色结晶粉末 | 170~ 172℃ | 易溶 于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
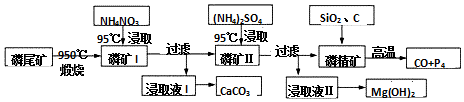

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com