
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.05 mol·L-1Fe2(SO4)3溶液中含Fe3+数目小于0.1 NA
B.30g甲醛中含电子对数为4NA
C.12 g石墨烯(单层石墨)中含有六元环的个数是0.5NA
D.室温下,7.1 g氯气与足量石灰乳充分反应转移电子数小于0.1 NA
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源:2014-2015浙江省杭州市下学期高二4月月考化学试卷(解析版) 题型:选择题
下列物质的沸点的排列顺序正确的是
①丁烷 ②2-甲基丙烷 ③正戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷
A.①>②>③>④>⑤ B.⑤>④>③>②>①
C.③>④>⑤>①>② D.②>①>⑤>④>③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东齐鲁名校教科研协作体19所名校高三第二次调研化学试卷(解析版) 题型:选择题
下列推断合理的是
A.一定条件下,使用催化剂能加快反应速率并能提高反应物的平衡转化率
B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解
C.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
D.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列叙述中,正确的是
A.天然纤维和人造纤维的主要成分都是纤维素
B.用活性炭为糖浆脱色和用臭氧漂白纸浆,原理相似
C.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀
D.黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第二次模拟化学试卷(解析版) 题型:选择题
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca =CaCl2+Li2SO4+Pb下列有关说法正确的是:(Pb的相对原子质量:207)
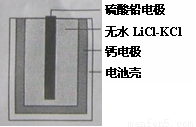
A.正极反应式:Ca+2Cl- - 2e-=CaCl2
B.常温时,在正负极间接上电流表或检流计,指针不偏转。
C.放电过程中,Li+向负极移动
D.每转移0.1mol电子,理论上生成20.7gPb
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省“江淮十校”高三4月联考理综化学试卷(解析版) 题型:填空题
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。相关信息如下表所示,根据推断回答下列问题(答题时A、B、C、D、E用所对应的元素符号表示)
A | A的一种单质在自然界中硬度最大 |
B | B元素的第一电离能比同周期相邻两个元素都大在同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
C | D的基态原子M层电子数是K层的2 倍 |
D | E与C位于不同周期,E原子核外最外层电子数与C相同其余各层电子均充满 |
(1)E在周期表中位于第_______周期第 ________族,C基态原子核外电子排布式是_______。
(2)A、B、D三种元素电负性由大到小排列顺序为________,其中A的最高价氯化物为_______(填“极性分子”或“非极性分子”)。
(3)A和B的最简单氢化物中沸点较高的______。原因是__________。
(4)已知:①AH4(g)+2BO2(g)-B2(g)+AO2(g)+2H2O(g)  H1= -867 kJ·mol-1
H1= -867 kJ·mol-1
②2BO2(g)-B2 O4(g)  H2=-56.9 kJ·mol-1写出AH4和B2O4反应的热化学方程式 。
H2=-56.9 kJ·mol-1写出AH4和B2O4反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省“江淮十校”高三4月联考理综化学试卷(解析版) 题型:选择题
我国京津冀地区部分城市常出现雾霾,其主要成分为细颗粒、SO2和NxOy小重金属离子及芳香烃等,对环境危害极大,对其治理越来越受到重视。下列说法正确的是
A.重金属离子Ag+、Cu2+、K+均可导致蛋白质变性
B.S02和NxOy都属于非金属氧化物,也都是酸性氧化物
C.部分颗粒分散在空气中可能会形成丁达尔现象
D.苯和苯的衍生物都是芳香烃
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:实验题
(15分)CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)=CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:____。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05 g过氧化钙样品,置于250 mL的锥形瓶中;
步骤2:分别加入30 mL蒸馏水和2 mL盐酸(3 mol·L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5 mL KI溶液(100 g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后________,用硫代硫酸钠标准溶液继续滴定,________,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2===Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是____。
(3)加入KI溶液后发生反应的离子方程式为____。
(4)请补充完整实验步骤4中的内容:____________;____________。
Ⅲ.测定含有CaO杂质的CaO2含量的实验方法较多,某同学设计了仅用稀盐酸一种药品(仪器可任选)较为准确地测出CaO2含量的实验,请你帮该同学列出所需仪器清单(实验用品和用于固定的或连接的仪器可不写)。
(5)仪器:________________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市高三质量监测三理综化学试卷(解析版) 题型:推断题
选考【化学—选修5:有机化学基础】(15分)丙二醇是重要的化工原料,利用甘油制备二元醇符合绿色化学要求。
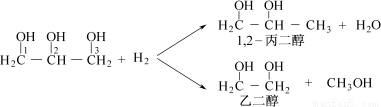
利用1,2-丙二醇可制得乳酸〔CH3CH(OH)COOH〕,乳酸与上述反应中的某一产物B可以反应,转换关系如下。已知A的碳原子数与乳酸相同,E、F为链状高分子化合物。请回答下列问题:
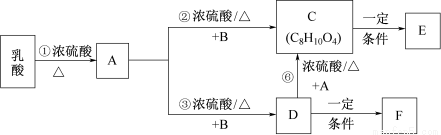
(1)反应①的反应类型是 ,A中所含官能团名称是 。
(2)B在一定条件下反应生成分子式为C2H4O的有机物,该物质不能发生银镜反应,核磁共振氢谱中只有一个峰,写出该物质的结构简式_______________。
(3)F具有良好的光学性能和亲水性可作为隐形眼镜的材料,写出由D制备F的化学方程式 。
(4)写出1,2-丙二醇制备乳酸的合成路线 。
(5)物质C(C8H10O4)存在含有苯环的同分异构体,已知:①一个C原子上连两个羟基不稳定;②苯环上含有4个取代基;分子中含有两个–CH2OH。符合上述条件的C的同分异构体有 种,写出其中一种的同分异构体的结构简式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com