
天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)、乙硫醇(C2H5SH)],可以用氢氧化钠溶液洗涤除去。
(1)硫元素的原子结构示意图为 ;羰基硫分子的电子式为 。
(2)下列说法正确的是 。
a. 乙硫醇的相对分子质量大于乙醇,故其沸点更高
b. 同温度同浓度下Na2CO3溶液的pH大于Na2SO4溶液,说明硫元素非金属性强于碳元素
c. H2S分子和CO2都是极性分子,因为它们都是直线形分子
d. 由于乙基的影响,乙硫醇的酸性弱于H2S
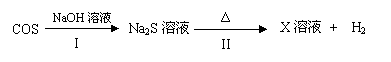 (3)羰基硫用氢氧化钠溶液处理及利用的过程如下(部分产物已略去):
(3)羰基硫用氢氧化钠溶液处理及利用的过程如下(部分产物已略去):
①反应I除生成两种正盐外,还有水生成,其化学方程式为 。
②已知X溶液中硫元素的主要存在形式为S2O32-,则II中主要反应的离子方程式为 。
③右图是反应II中,在不同反应温度下,反应时间与H2产量的关系图
(Na2S初始含量为3 mmo1)。
a. 判断T1、T2、T3的大小: ;
b. 在T1温度下,充分反应后,若X溶液中除S2O32-外,还有因发生副反应而同时产生的SO42-,则溶液中c(S2O32-):c(SO42-)= 。
科目:高中化学 来源: 题型:
禁止使用兴奋剂是奥运会保证运动员比赛公平的重要举措之一.以下两种兴奋剂结构分别为:

则关于它们的说法中正确的是( )
A. 利尿酸分子中有三种官能团
B. 两种分子中的所有碳原子均不可能共平面
C. 两种兴奋剂均属于芳香烃
D. 两种分子均可发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
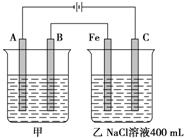
如图所示,甲、乙为相互串联的两电解池.
(1)甲池若为用电解原理精炼铜的装置,则A电极名称为阴极,电极材料是 ,电极反应式为 ,电解质溶液可以是 .
(2)乙池中Fe极电极反应式为 ,若在乙池中滴入少量酚酞试液,开始电解一段时间,Fe极附近呈 色.
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化,
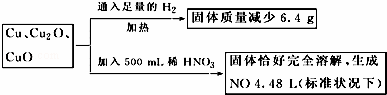
则转化过程中所加稀HNO3的物质的量浓度为( )
A.4.4 mol·L﹣1 B.3.6 mol·L﹣1
C.4.0 mol·L﹣1 D.3.2 mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均可视为零价),电池放电时发生的反应通常表示为LaNi5H6+6NiO(OH)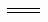 LaNi5+6Ni(OH)2,下列说法正确的是
LaNi5+6Ni(OH)2,下列说法正确的是
A.放电时储氢合金作正极
B.充电时储氢合金作负极
C.充电时阳极周围c(OH-)减少
D.放电时负极反应为LaNi5H6 -6e-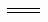 LaNi5 +6H+
LaNi5 +6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
I.将0.40mol N2O4气体充入2 L固定容积的密闭容器中发生如下反应:N2O4(g) 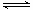 2NO2(g) △H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
2NO2(g) △H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
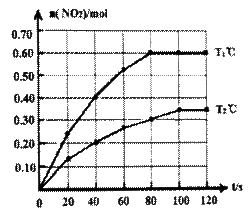
(1)Tl℃时,40s~80s内用N2O4表示该反应的平均反应速率为_________________mol/(L·s)。
(2)△H___________0(填“>”、“<”或“=”)。
(3)改变条件重新达到平衡时,要使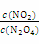 的比值变小,可采取的措施有__________(填序号)。
的比值变小,可采取的措施有__________(填序号)。
a.增大N2O4的起始浓度 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
II.已知:常温下,HCN的电离常数为Ka=5×10-10。
(4)有浓度相同的HCN和NaCN的混合溶液。
①通过计算说明该溶液的酸碱性_____________________________________________。
②该溶液中各离子的浓度由大到小的顺序是___________________________________。
(5)常温下,向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性。
①该过程溶液中水的电离程度的变化为______________。
②若混合溶液中c(Na+)=a mol/L,则c(HCN)=_________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com