
| A. | P-P键的键能大于P-Cl键的键能 | |
| B. | 可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H | |
| C. | Cl-Cl键的键能$\frac{b-a+5.6c}{4}$ kJ•mol-1 | |
| D. | 1molP4含4molp-p键 |
分析 A、依据P和Cl原子半径大小比较键长得到键能大小,键长越长,键能越小;
B、①P4(s)+6Cl2(g)═4PCl3(g)△H=a kJ•mol-1
②P4(s)+10Cl2(g)═4PCl5(g)△H=b kJ•mol-1
依据盖斯定律$\frac{②-①}{4}$,分析判断;
C、依据焓变=反应物键能之和-生成物键能之和计算分析;
D、由P4是正四面体可知P4中含有6个P-P键.
解答 解:A、原子半径P>Cl,因此P-P键键长大于P-Cl键键长,则P-P键键能小于P-Cl键键能,故A错误;
B、①P4(s)+6Cl2(g)═4PCl3(g)△H=a kJ•mol-1
②P4(s)+10Cl2(g)═4PCl5(g)△H=b kJ•mol-1
依据盖斯定律$\frac{②-①}{4}$可求出Cl2(g)+PCl3(g)=PCl5(g)△H=$\frac{b-a}{4}$KJ•mol-1,但不知PCl5(g)=PCl5(s)的△H,因此无法求出Cl2(g)+PCl3(g)=PCl5(s)的△H,故B错误;
C、利用Cl2(g)+PCl3(g)=PCl5(g)△H=$\frac{b-a}{4}$KJ•mol-1可得E(Cl-Cl)+3×1.2c-5c=$\frac{b-a}{4}$,因此可得E(Cl-Cl)=$\frac{b-a+5.6c}{4}$kJ•mol-1,故C正确;
D、由P4是正四面体可知P4中含有6个P-P键,所以1molP4含6molp-p键,故D错误;
故选C.
点评 本题考查了化学键与焓变定量计算关系,物质结构的分析应用,盖斯定律的计算应用,题目难度中等.


科目:高中化学 来源: 题型:实验题
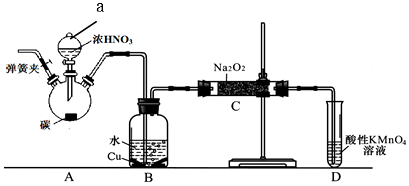
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20 | B. | 0.25 | C. | 0.30 | D. | 0.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③ | C. | ②③④ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 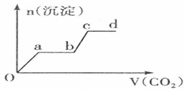 | B. | 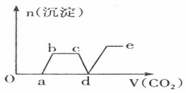 | ||
| C. | 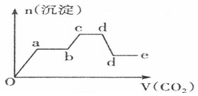 | D. | 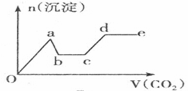 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO固体(Al2O3) | B. | Na2CO3固体(NaHCO3) | ||
| C. | FeCl2溶液(CuCl2) | D. | Fe2O3固体(SiO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
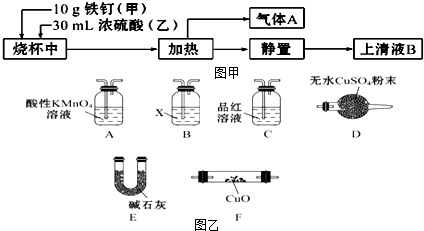
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
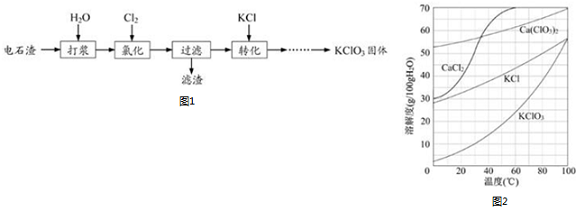
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com