
| A. | 纯碱不是碱 | B. | 甘油不是油 | C. | 双氧水不是水 | D. | 醋酸不是酸 |
科目:高中化学 来源: 题型:解答题
 对氯苯甲酸是一种药物中间体,可用对氯甲苯为原料,通过高锰酸钾氧化法制备.反应如下:
对氯苯甲酸是一种药物中间体,可用对氯甲苯为原料,通过高锰酸钾氧化法制备.反应如下: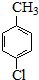 $→_{催化剂}^{KMnO_{4}}$
$→_{催化剂}^{KMnO_{4}}$
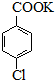 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$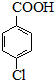
| 熔点/℃ | 沸点/℃ | 密度/g•cmˉ3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐,溶解度随温度升高而增大 | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 | |
| B. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1可知,若将含1 mol CH3COOH的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量小于57.3kJ | |
| C. | 300℃、30MPa下,将0.5molN2(g)和1.5mol H2(g)置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | 由C(石墨)=C(金刚石)△H=+1.90 kJ•mol-1可知,金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,氢元素含量最高的烃的分子式CH4.
,氢元素含量最高的烃的分子式CH4.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与氢气化合比溴与氢气化合容易 | |
| B. | 硒化氢比硫化氢稳定 | |
| C. | 氢氧化锶比氢氧化钙的碱性强 | |
| D. | 铍的原子失电子能力比镁弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
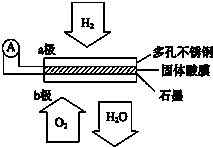 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )| A. | 电子通过外电路从b极流向a极 | |
| B. | b极上的电极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 每转移0.1 mol电子,消耗标准状况下1.12 L的H2 | |
| D. | OH-由a极通过固体酸电解质传递到b极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com