
 H++H2PO2-;
H++H2PO2-; H++H2PO2-;
H++H2PO2-;

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Sn4+、Fe3+、Ce4+ |
| B、Ce4+、Fe3+、Sn4+ |
| C、Sn4+、Ce4+、Fe3+ |
| D、Fe3+、Sn4+、Ce4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol氢的质量为2g |
| B、OH-的摩尔质量为17g |
| C、标准状况下,水的摩尔体积是22.4 L?mol-1 |
| D、1mol Ne 含有的电子数目为6.02×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
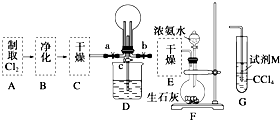 某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如图:
某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硫化钠溶液中加入足量稀硝酸:S2-+2H+=H2S↑ | ||||
| B、往氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓ | ||||
C、用惰性电极电解饱和食盐水:2Cl-+2H2O
| ||||
D、乙醛的银镜反应:CH3CHO+2Ag(NH3)2OH
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、上述正反应为吸热反应 | ||
| B、在4MPa、1200K时,图中X点υ(H2)正>υ(H2)逆 | ||
C、在5MPa、800K时,该反应的平衡常数为
| ||
| D、工业上维持6MPa 1000K而不采用10MPa1000K,主要是因为前者碳的转化率高 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com