




 (注明反应条件),因此,在碱性条件下,由Ⅳ与
(注明反应条件),因此,在碱性条件下,由Ⅳ与 反应生成Ⅱ,其反应类型为取代反应.
反应生成Ⅱ,其反应类型为取代反应.分析 (1)根据结构简式判断含有的元素种类和原子个数可确定分子式;
(2)化合物Ⅱ含有C=C,可与溴发生加成反应;
(3)化合物Ⅲ在碱性条件下水解生成化合物Ⅳ,可由Ⅳ确定Ⅲ的结构;
(4)化合物Ⅳ易发生消去反应生成不含甲基的产物,应生成CH2=CHCH=CH2;由Ⅳ与CH3CO-Cl反应生成Ⅱ,发生取代反应;
(5)Ⅲ为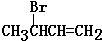 ,首先分析碳链异构的种类,再分别分析官能团异构的种类.
,首先分析碳链异构的种类,再分别分析官能团异构的种类.
解答 解:(1)化合物Ⅰ中含有7个C、5个H、1个O、1个Br,则分子式为C7H5OBr,故答案为:C7H5OBr;
(2)化合物Ⅱ含有C=C,可与溴发生加成反应,C=C变为C-C,生成物为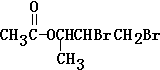 ,
,
故答案为: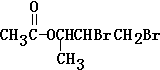 ;
;
(3)化合物Ⅲ在碱性条件下水解生成化合物Ⅳ,则由Ⅳ可知Ⅲ为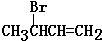 ,故答案为:
,故答案为: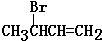 ;
;
(4)化合物Ⅳ易发生消去反应生成不含甲基的产物,应生成CH2=CHCH=CH2,反应的方程式为 ,Ⅳ与CH3CO-Cl反应生成Ⅱ,反应的方程式为
,Ⅳ与CH3CO-Cl反应生成Ⅱ,反应的方程式为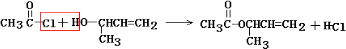 ,应为取代反应,
,应为取代反应,
故答案为: ;取代反应;
;取代反应;
(5)Ⅲ为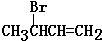 ,其碳链为链状时有正丁烷和异丁烷两种结构,正丁烷中,其同分异构体可以是CH2BrCH2CH=CH3,CH3CH2CBr=CH3,CH3CH2CH=CH2Br,CH3CBr=CHCH3,CH2BrCH=CHCH3,异丁烷的结构中,其同分异构体有CHBr=C(CH3)2,CH2=C(CH3)CH2Br,若碳链为环状时,可以是3元环,另有1个甲基和Br,有1种结构,若为4元环,有1种结构,所以Ⅲ的同分异构体共有9种,故答案为:9.
,其碳链为链状时有正丁烷和异丁烷两种结构,正丁烷中,其同分异构体可以是CH2BrCH2CH=CH3,CH3CH2CBr=CH3,CH3CH2CH=CH2Br,CH3CBr=CHCH3,CH2BrCH=CHCH3,异丁烷的结构中,其同分异构体有CHBr=C(CH3)2,CH2=C(CH3)CH2Br,若碳链为环状时,可以是3元环,另有1个甲基和Br,有1种结构,若为4元环,有1种结构,所以Ⅲ的同分异构体共有9种,故答案为:9.
点评 本题考查有机物的合成,题目难度不大,解答本题的关键是把握有机物官能团的转化和性质,答题时注意审题,把握题给信息.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①②④ | C. | ①②④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2 | B. | NO2 | C. | SO3 | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际单位制中7个基本物理量之一 | |
| B. | 物质的量就是物质的质量 | |
| C. | 物质的量像一座桥梁,把物质的质量或体积等宏观量与微观粒子的数量联系起来 | |
| D. | 是表示物质数量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用原电池原理合成硫酸成为可能,如图利用SO2和O2制备硫酸.其中A、B为多孔材料,可吸附气体.回答下列问题.
利用原电池原理合成硫酸成为可能,如图利用SO2和O2制备硫酸.其中A、B为多孔材料,可吸附气体.回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NaHCO3溶液中离子浓度关系:C(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 0.1mol/L NH4Cl和0.1mol/L NH3•H2O等体积混合后离子浓度关系:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)>c(NO3-) | |
| D. | 常温下,在pH=1的溶液中,Fe2+、NO3-、ClO-、Na+能大量共存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com