
【题目】常温下,将0.1molL1的NaOH溶液逐渐加到5mL0.1molL1的一元酸HA溶液中,测得混合溶液的BG(BG=-lg![]() )与所加NaOH的体积的变化关系如图所示。
)与所加NaOH的体积的变化关系如图所示。
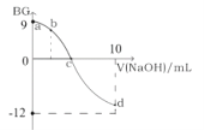
下列叙述错误的是( )
A.该滴定过程可选用酚酞做指示剂
B.c点所加的NaOH溶液的体积小于5mL
C.从a点到c点,水的电离程度一直增大
D.若b点所加的NaOH溶液的体积等于2.5mL,则所得溶液中:c(H+)=c(HA)+c(OH)+c(Na+)
【答案】D
【解析】
A.常温下,0.1molL1的一元酸HA溶液的BG=9,即![]() =10-9,由水的离子积常数知c(H+)×c(OH-)=10-14,解得c(H+)=1.0×10-2.5molL1<0.1molL1,故一元酸HA为弱酸,将0.1molL1的NaOH溶液逐渐加到5mL0.1molL1的一元酸HA溶液中,滴定终点生成的强碱弱酸盐,所以选择酚酞作指示剂,A正确;
=10-9,由水的离子积常数知c(H+)×c(OH-)=10-14,解得c(H+)=1.0×10-2.5molL1<0.1molL1,故一元酸HA为弱酸,将0.1molL1的NaOH溶液逐渐加到5mL0.1molL1的一元酸HA溶液中,滴定终点生成的强碱弱酸盐,所以选择酚酞作指示剂,A正确;
B.c点时BG=0,则溶液中c(H+)=c(OH-),溶液呈中性,如果加入的0.1molL1的NaOH溶液的体积为5mL,恰好与5mL0.1molL1的一元酸HA溶液完全反应生成NaA,NaA为强碱弱酸盐,溶液呈碱性,故c点所加的NaOH溶液的体积小于5mL,B正确;
C.从a点到c点,随着NaOH溶液不断加入,HA的量不断减小,对水的电离的抑制作用不断减小,故从a点到c点,水的电离程度一直增大,C正确;
D.若b点所加的NaOH溶液的体积等于2.5mL,c(HA)=c(NaA),因为HA是弱酸,所以c(H+)<c(Na+),故c(H+)<c(HA)+c(OH)+c(Na+),D错误;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学在室温下进行下图所示实验。(已知:H2C2O4为二元弱酸)
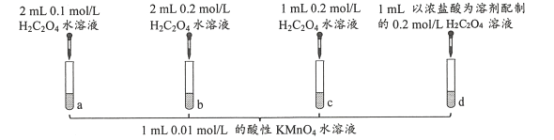
试管a、b、c中溶液褪色分别耗时690s、677s、600s。下列说法正确的是
A.反应的离子方程式为2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
B.试管c反应至300 s时,溶液中剩余的c(KMnO4)=0.0025 mol/L
C.对比试管a、b,得到的结论是H2C2O4水溶液浓度增大,反应速率加快
D.对比试管c、d,可验证H+浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是
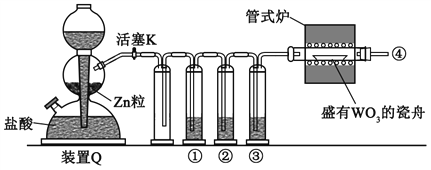
A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四苯基乙烯(TPE)及其衍生物具有诱导发光特性,在光电材料等领域应用前景广泛。以下是TPE的两条合成路线(部分试剂及反应条件省略):
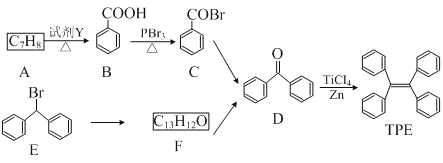
(1)A的名称是__________________;试剂Y为____________________。
(2)B→C的反应类型为_______________;B中官能团的名称是_________________,D中官能团的名称是_______________。
(3)E→F的化学方程式是______________________________________。
(4)W是D的同分异构体,具有下列结构特征:①属于萘(![]() )的一元取代物;②存在羟甲基(-CH2OH)。写出W所有可能的结构简式:______________________。
)的一元取代物;②存在羟甲基(-CH2OH)。写出W所有可能的结构简式:______________________。
(5)下列叙述正确的是______。
a. B的酸性比苯酚强
b. D不能发生还原反应
c. E含有3种不同化学环境的氢
d. TPE既属于芳香烃也属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为___mol·L-1。
(2)一定条件下,PbO2与Cr3+反应,产物是![]() 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为____mol;
和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为____mol;
(3)在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为___________。
(4)自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3-,产物是N2。发生的反应可表示如下,请完成方程式的配平。Al+NO3-+ —AlO2-+N2↑+H2O,_____________
(5)某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是__________。
②若该反应方程式中I2和KIO3的计量数分别是是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4+KI+H2SO4→__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)实验室用图甲装置制备SO3并测定SO2催化氧化为SO3的转化率。
已知:SO3熔点为16.8℃,沸点为44.8℃,假设气体进入装置可以被完全吸收,不考虑空气的影响。

(1)A中使用浓硫酸的质量分数为70%的原因是___,B中浓H2SO4的作用是___。
(2)当实验停止通入SO2,熄灭酒精灯后,还需要继续通一段时间的氧气,其目的是___。
(3)实验结束后测得装置D增加了ag,装置E中的沉淀洗涤烘干后其质量为bg。则E中的沉淀的化学成分是___(填写化学式),本实验中SO2转化率为___(用代数式表示,不用化简)。
(二)SO3溶于浓硫酸后可得到发烟硫酸,工业上把干燥的氯化氢气体通入到发烟硫酸中可以得到HSO3Cl。HSO3Cl是一种无色液体,沸点为152℃,有强腐蚀性,遇湿空气产生强烈的白雾。现用图乙所示的装置制取HSO3Cl(夹持及加热装置略去)。

(1)HSO3Cl遇湿空气产生强烈的白雾,请结合用化学方程式解释其原因___。
(2)分液漏斗下方接的毛细管,其作用是___;若不用毛细管而直接用分液漏斗注入浓盐酸,可能发生的现象是___。
(3)装置F的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的A、B、C、D、E五种元素,原子序数逐渐增大。A元素核外有三个电子层,最外层电子数是核外电子总数的1/6;B元素核外只有一个未成对电子,能与水剧烈反应;C元素正三价离子的3d轨道为半充满状态;D元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;E元素的价电子构型为nsanpa+1,其某种氧化物有剧毒。
(1)A元素的第一电离能___Al元素的第一电离能(填“<”“>”或“=”),请解释原因___。
(2)写出B2O2与H2O反应过程中断裂的化学键的种类___。
(3)C元素位于元素周期表的___区,它的价电子排布式是___,C(CO)x的中心原子价电子数与配位数提供的电子数之和为18,则x=___。
(4)D2O的熔点比D2S的熔点高,其原因是___。
(5)ECl3分子的立体构型为___,其中E的杂化类型为___,E元素可能的性质为___(从下列选项中选择)。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
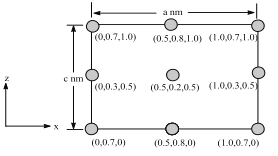
(6)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。BSiAl3O7属于正交晶系(长方体形),晶胞参数为anm、bnm、cnm。如图为沿y轴投影的晶胞中所有B原子的分布图和原子分数坐标。据此推断该晶胞中B原子数目为___;BSiAl3O7的摩尔质量为Mgmol-1,设NA为阿伏伽德罗常数的值,则晶体的密度=___(gcm3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全气囊逐渐成为汽车的标配,因为汽车发生剧烈碰撞时,安全气囊中迅速发生反应:10NaN3+2KNO3![]() K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
K2O+5Na2O+16N2↑,产生大量的气体使气囊迅速弹出,保障驾乘车人员安全。下列关于该反应的说法不正确的是
A. 该反应中NaN3是还原剂,KNO3是氧化剂
B. 氧化产物与还原产物的物质的量之比为15∶1
C. 若有50.5 g KNO3参加反应,则有1 mol N原子被还原
D. 每转移1 mol e,可生成标准状况下N2的体积为35.84 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)丙溶液中存在的电离平衡为______________(用电离平衡方程式表示)。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③ c(CH3COOH)/c(CH3COO-) ④c(OH-)
(4)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为___________。
(5)某同学用甲溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:
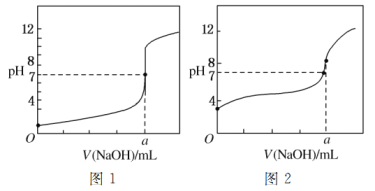
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”)曲线。
②a=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com