
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(Na+)+c(H+)═c(HRO3-)+c(RO32-)+c(OH-) | |
| C. | c(RO32-)+c(HRO3-)+c(H2RO3)═c(Na+) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
分析 NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,NaHCO3溶液呈碱性,说明HCO3-水解沉淀大于电离程度,
两溶液中发生的过程相似,①溶质电离:NaHRO3=Na++HRO3-,②HRO3-电离:HRO3-?H++RO32-,
③HRO3-水解:HRO3-+H2O?H2RO3+OH-,④水电离:H2O?H++OH-.
由溶液呈电中性有电荷守恒关系(a):c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-);
据化学式NaHRO3得物料守恒关系(b):c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3);
(a)-(b)得质子守恒关系(c):c(H+)+c(H2RO3)=c(RO32-)+c(OH-).
对NaHSO3溶液,过程②的程度大于③,有c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
对NaHCO3溶液,过程③的程度大于②,有c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+).
同浓度的两溶液中,c(Na+)相等,c(HRO3-)不一定相等,c(SO32-)>c(CO32-).
解答 解:A.NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,c(H+)>>c(OH-),NaHCO3溶液呈碱性,说明HCO3-水解沉淀大于电离程度,c(OH-)>c(H+),故A错误;
B.由溶液呈电中性有电荷守恒关系:c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),故B错误;
C.根据化学式NaHRO3得物料守恒关系:c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),故C正确;
D.同浓度的两溶液中,c(Na+)相等,c(HRO3-)不一定相等,c(SO32-)>c(CO32-),故D错误;
故选C.
点评 本题考查离子浓度的大小比较,题目难度较大,注意从守恒的角度分析,还要注意题目要求,即“浓度均为浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液中均存在的关系”此为解答该题的关键之处,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
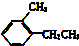 ②
② ③
③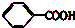 ④TNT
④TNT查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al→[Al(OH)4]- | B. | Na2CO3→NaOH | C. | Al2O3→Al(OH)3 | D. | Fe(OH)2→Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4NH3+6NO→5N2+6H2O | B. | 2NH3+3CuO→3Cu+N2+3H2O | ||
| C. | 2Na+2NH3→2NaNH2+H2↑ | D. | 4NH3+3O2→4N2+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂的物质的量比为8:3 | |
| B. | 被还原的HNO3和起酸性作用的HNO3的物质的量的比为2:3 | |
| C. | 生成1molNO气体转移的电子数为3NA | |
| D. | 该反应中Cu(NO3)2 为氧化产物,H2O为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始时V正增大,V逆减小,最终SO3的百分含量增加 | |
| B. | 开始时V正增大,V逆不变,最终SO3的百分含量不变 | |
| C. | 开始时V正增大,V逆增大,最终SO3的百分含量无法判断 | |
| D. | 开始时V正增大,V逆减小,最终SO3的百分含量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
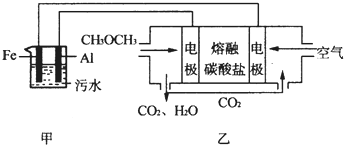
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
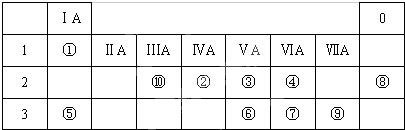
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com