
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去).下列推断不正确的是
![]()
A. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B. 若D为NaOH,则A、B、C均可与X反应生成D
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D为H2SO4,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W是原子序数依次增大的前四周期元素。其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元索形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子。请回答下列问题:
(1)X、Y、Z的第一电离能从大到小的顺序是_______ (用元素符号表示,下同)。
(2)写出W的价电子排布式________ ,W同周期的元素中,与W原子最外层电子数相等的元素还有_______。
(3)根据等电子体原理,可知化合物XZ的结构式是______,YZ2-的VSEPR模型是________。
(4)X、Y、Z的简单氢化物的键角从大到小的顺序是________(用化学式表示),原因是____________________。
(5)由元素Y与U元素组成的化合物A,晶胞结构如图所示(黑球表示Y原子,白球表示U原子),请写出化合物A的化学式_______,该物质硬度大,推测该物质为______晶体。其中Y元素的杂化方式是____________。

(6)U的晶体属立方晶系,其晶胞边长为405Pm,密度是2.70g·cm-3,通过计算确定其晶胞的类型________________(堆简单立方堆积、体心立方堆积或面心立方最密堆积)(己知:4053=6.64×107)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居室空气污染的主要来源之一是人们使用的装饰材料,胶合板、内墙涂料会释放出一种刺激性气味的气体,该气体是( )
A.甲烷B.甲醛C.氨气D.二氧化硫
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室拟将适量浓硝酸分多次加入铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。

(1)图1烧瓶中随着反应分进行,可能发生反应的离子方程式为①____________________;
②_______________________________________。
(2)图2是图1的改进装置,其优点有:①_______________________________________;
②________________________________________________________________________。
(3)为符合绿色化学的要求,进行如下设计:
方案1:以空气为氧化剂,将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将3.2g铜丝放入45mL1.5mol·L-1的稀硫酸中,控温在50℃。加入18g10%的H2O2溶液,反应0.5小时后,升温到60℃,持续反应1小时后,过滤、蒸发、结晶、减压抽滤后,用少量95%的酒精淋洗后晾干,得10.6gCuSO4·5H2O。请回答下列问题:
①方案1中仪器B的名称是________________。
②方案2中生成CuSO4·5H2O的产率是________(保留三位有效数字)。
③上述两种方案中,更符合绿色化学理念的是________(填“方案1” 或“方案2”),理由是:该方案的优点是__________________________________________________;
另一方案的缺点是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成细胞的元素、化合物以及细胞的结构和功能的叙述,错误的是
A. 葡萄糖、脱氧核糖和脂肪都只含C、H、0三种元素
B. 脂质具有构成生物膜、调节代谢和储存能量等生物学功能
C. 在光学显微镜下观察洋葱根尖细胞可以看见球形的叶绿体
D. 无机盐大多以离子形式存在,具有维持细胞酸碱平衡的功能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A. SO2具有氧化性,常用于漂白秸秆、织物
B. 明矾水解形成Al(OH)3胶体,可用作水处理中的消毒剂
C. 白葡萄酒含维生素C 等多种维生素,通常添加微量SO2,以防止营养成分被氧化
D. 次氯酸有酸性,可用于自来水的杀菌消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,把2.5 mol A和2.5 mol B混合盛入容积为2 L的密闭容器里,发生如下反应:3A(g)+B(s)![]() x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
x C(g)+2D(g),经5 s反应达平衡,在此5 s内C的平均反应速率为0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. 反应达到平衡状态时A的转化率为60%
B. x=4
C. 反应达到平衡状态时,相同条件下容器内气体的压强与起始时压强比为6∶5
D. 若混合气体的密度不再变化,则该可逆反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(选修三——物质结构与性质)氮和磷元素的单质和化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列问题:
(l)科学家合成了一种阳离子为“N5n+”、其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式分“N8”的离子晶体,其电子式为__________________,其中的阴离子的空间构型为_________。
(2)2001年德国专家从硫酸钱中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子的形式存在。N4H44+根系易吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。1个N4H44+中含有______个σ键。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因_________________________。
(4)P4S3可用于制造火柴,其分子结构如图l所示。

①P4S3分子中硫原子的杂化轨道类型为_______。
②每个P4S3分子中含孤电子对的数月为_______。
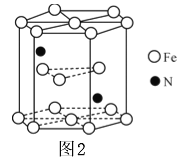
(5)某种磁性氮化铁的晶胞结构如图2所示,该化合物的化学式为______。若晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为_______g/㎝3(用含a c和NA的式子表示)
(6)高温超导材料,是具有高临界转变温度(Te)能在液氮温度度条件下工作的超导材料。高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为[Ar]______;化合物中,稀土元素最常见的化合价是+3 ,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是_____________。
几种稀土元素的电离能(单位:KJ/mol)
元素 | I1 | I2 | I3 | I4 |
Se(钪) | 633 | 1235 | 2389 | 7019 |
Y(铱) | 616 | 1181 | 1980 | 5963 |
La(镧) | 538 | 1067 | 1850 | 4819 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果用0.3 mol·L1的亚硫酸钠溶液16mL,恰好将3.2×103mol的强氧化剂[RO(OH)2]2+溶液的溶质还原到较低价态。则反应后R的最终价态为
A. 0 B. +1 C. +2 D. +3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com