
 50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:
50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算反应热.请回答下列问题:分析 (1)根据量热计的构造来判断该装置的缺少仪器;
(2)中和热测定实验成败的关键是保温工作;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失;
(4)先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出中和热,然后根据热化学方程式的书写方法书写;
(5)根据浓硫酸稀释时放热.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
故答案为:减少实验过程中的热量损失;
(3)大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小;
故答案为:偏小;
(4)平均温度差为3.4℃,50mL 0.5mol/L的盐酸与50mL0.55mol/L的NaOH溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为100g,温度变化的值为3.4℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.4℃=1421.2J,即1.4212KJ,所以实验测得的中和热△H=-$\frac{1.4212kJ}{0.025mol}$=-56.8kJ/mol,该反应中和热和热化学方程式为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ/mol;
故答案为:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-56.8kJ/mol;
(5)浓硫酸稀释时放热,所以用浓硫酸代替盐酸溶液进行上述实验,反应放出的热量偏大,测得中和热的数值会偏大,故答案为:偏大.
点评 本题考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热测定原理以及测定中和热的误差等问题,试题有利于培养学生灵活应用所学知识的能力.


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:解答题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | N | O | F | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 高中化学教材介绍了部分常见的金属与非金属元素及其化合物的相关知识,试回答下列问题
高中化学教材介绍了部分常见的金属与非金属元素及其化合物的相关知识,试回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:填空题
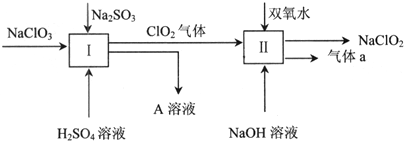
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36,Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子.
原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36,Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | P的平均反应速率是0.15mol/(L•min) | B. | Q的转化率是25% | ||
| C. | Q的平衡浓度是1mol/L | D. | x的值为2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑦ | B. | ③⑤⑧ | C. | ④⑥ | D. | ②③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com