

分析 I.①Mg在二氧化碳中燃烧生成C和MgO;
②根据元素的化合价变化及电子转移的数目来用“双线桥法”表示反应中电子转移的方向和总数,箭头的起点和终点都指向同种元素;
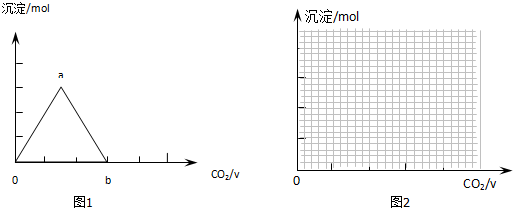
II.CO2与Ca(OH)2反应生成碳酸钙沉淀,当CO2过量碳酸钙又溶解生成碳酸氢钙;
III.CO2通入KOH和Ca(OH)2的混合溶液中,CO2先与Ca(OH)2反应生成碳酸钙沉淀,然后再与KOH反应生成碳酸钾,二氧化碳过量时与碳酸钾反应生成碳酸氢钾、与碳酸钙反应生成碳酸氢钙.
解答 解:Ⅰ.①Mg在二氧化碳中燃烧生成C和MgO,其反应为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,Mg元素的化合价升高被氧化,则氧化产物为MgO;
故答案为:MgO;
②在反应2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C中,C元素的化合价由+4降低为0,得4e-,Mg元素的化合价由0升高到+2,失2×2e-,则
用“双线桥法”表示反应中电子转移的方向和总数为 ,
,
故答案为: ;
;
II.CO2与Ca(OH)2反应生成碳酸钙沉淀,当CO2过量碳酸钙又溶解生成碳酸氢钙,则图中沉淀变化由a到b的离子方程式:CaCO3+CO2+H2O=Ca2++2HCO3-;
故答案为:CaCO3+CO2+H2O=Ca2++2HCO3-;
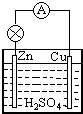
III.CO2通入KOH和Ca(OH)2的混合溶液中,CO2先与Ca(OH)2反应生成碳酸钙沉淀,发生Ca2++CO2+2OH-=CaCO3↓+H2O,生成的碳酸钙沉淀的物质的量与II中相同,然后再与KOH反应生成碳酸钾,反应的离子方程式为:CO2+2OH-=CO32-+H2O,二氧化碳过量时与碳酸钾反应生成碳酸氢钾,此时碳酸钙沉淀的物质的量不变,反应的离子方程式为:CO32-+CO2+H2O=2HCO3-,最后与碳酸钙反应生成碳酸氢钙,发生CaCO3+CO2+H2O=Ca2++2HCO3-,沉淀的物质的量减少,最后消失,则生成沉淀的物质的量(n)和通入CO2体积(V)的关系图为 ;
;
故答案为: ;Ca2++CO2+2OH-=CaCO3↓+H2O、CO2+2OH-=CO32-+H2O;CO32-+CO2+H2O=2HCO3-、CaCO3+CO2+H2O=Ca2++2HCO3-.
;Ca2++CO2+2OH-=CaCO3↓+H2O、CO2+2OH-=CO32-+H2O;CO32-+CO2+H2O=2HCO3-、CaCO3+CO2+H2O=Ca2++2HCO3-.
点评 本题考查了氧化还原反应、双线桥法的应用、离子反应、二氧化碳的性质等,题目难度中等,侧重于考查学生分析能力和对基础知识的综合应用能力.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 56g铁被氧化时,失去电子数目一定是2NA | |
| B. | 常温常压下,71g Cl2中含电子总数为34NA | |
| C. | 标准状况下,2.24L SO3中,含分子总数为0.1NA | |
| D. | CnH2n+2分子中含有共价键数为(3n+1)NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
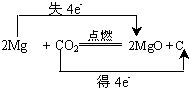
 原电池是直接把化学能转化为电能的装置.如图所示:
原电池是直接把化学能转化为电能的装置.如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X=Y+0.01 | B. | X=2Y | C. | Y=2X | D. | X=Y+0.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
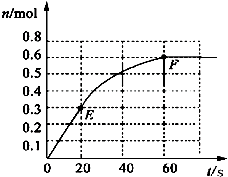 373K时,某1L密闭容器中加入1mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.
373K时,某1L密闭容器中加入1mol NH3发生如下可逆反应:2NH3(g)?N2(g)+3H2(g).其中物质H2的物质的量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液化石油气和天然气的主要成分都是甲烷 | |
| B. | 糖类、脂类、蛋白质都属于天然高分子化合物 | |
| C. | 汽油、煤油、植物油均为含碳氢氧三种元素的化合物 | |
| D. | 误服重金属盐,立即服用牛奶或豆浆可解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氢氧化钠的反应可自发进行,因此可用作原电池反应原理 | |
| B. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| C. | 生石灰、铁粉、硅胶是食品包装中常用的干燥剂 | |
| D. | 铝表面可生成一层致密的氧化物薄膜,因此可用铝容器盛装稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com