
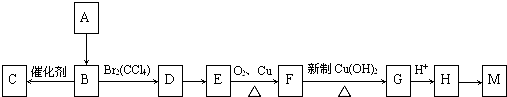
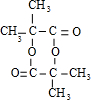 .
.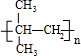 ;E→F:2(CH3)2C(OH)-CH2OH+O2$→_{△}^{Cu}$2(CH3)2C(OH)-CHO+2H2O.
;E→F:2(CH3)2C(OH)-CH2OH+O2$→_{△}^{Cu}$2(CH3)2C(OH)-CHO+2H2O.分析 A是卤代烃,相对分子质量为92.5,故A中含有1个Cl原子,剩余烃基式量为92.5-35.5=57,分子中最大C原子数目为$\frac{57}{12}$=4…9,故烃基为-C4H9,A的分子式为C4H9Cl,其核磁共振氢谱中只有一个峰,故A为C(CH3)3Cl,A转化得到B,B转化为高分子化合物C,则B含有不饱和键,故B为(CH3)2C=CH2,C为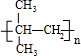 ,(CH3)2C=CH2与溴发生加成反应生成D为(CH3)2CBr-CH2Br,D转化得到E,E可以连续氧化生成G,应是D水解生成E,则E为(CH3)2C(OH)-CH2OH,F为(CH3)2C(OH)-CHO,F氧化生成G,G酸得到H,则H为(CH3)2C(OH)-COOH,G为(CH3)2C(OH)-COONa,H发生成环酯化反应生成M,则M为
,(CH3)2C=CH2与溴发生加成反应生成D为(CH3)2CBr-CH2Br,D转化得到E,E可以连续氧化生成G,应是D水解生成E,则E为(CH3)2C(OH)-CH2OH,F为(CH3)2C(OH)-CHO,F氧化生成G,G酸得到H,则H为(CH3)2C(OH)-COOH,G为(CH3)2C(OH)-COONa,H发生成环酯化反应生成M,则M为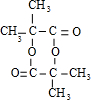 ,据此解答.
,据此解答.
解答 解:A是卤代烃,相对分子质量为92.5,故A中含有1个Cl原子,剩余烃基式量为92.5-35.5=57,分子中最大C原子数目为$\frac{57}{12}$=4…9,故烃基为-C4H9,A的分子式为C4H9Cl,其核磁共振氢谱中只有一个峰,故A为C(CH3)3Cl,A转化得到B,B转化为高分子化合物C,则B含有不饱和键,故B为(CH3)2C=CH2,C为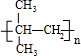 ,(CH3)2C=CH2与溴发生加成反应生成D为(CH3)2CBr-CH2Br,D转化得到E,E可以连续氧化生成G,应是D水解生成E,则E为(CH3)2C(OH)-CH2OH,F为(CH3)2C(OH)-CHO,F氧化生成G,G酸得到H,则H为(CH3)2C(OH)-COOH,G为(CH3)2C(OH)-COONa,H发生成环酯化反应生成M,则M为
,(CH3)2C=CH2与溴发生加成反应生成D为(CH3)2CBr-CH2Br,D转化得到E,E可以连续氧化生成G,应是D水解生成E,则E为(CH3)2C(OH)-CH2OH,F为(CH3)2C(OH)-CHO,F氧化生成G,G酸得到H,则H为(CH3)2C(OH)-COOH,G为(CH3)2C(OH)-COONa,H发生成环酯化反应生成M,则M为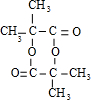 .
.
(1)由上述分析可知,A的分子式为C4H9Cl,A→B是C(CH3)3Cl在氢氧化钠醇溶液、加热条件下发生消去反应生成(CH3)2C=CH2,故答案为:C4H9Cl,消去反应;
(2)由上述分析可知,D为(CH3)2CBr-CH2Br,M的结构简式为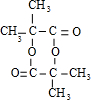 ,
,
故答案为:(CH3)2CBr-CH2Br;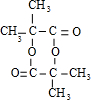 ;
;
(3)B→C是(CH3)2C=CH2发生加聚反应生成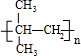 ,反应方程式为:n(CH3)2C=CH2$\stackrel{催化剂}{→}$
,反应方程式为:n(CH3)2C=CH2$\stackrel{催化剂}{→}$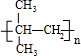 ,
,
E→F是(CH3)2C(OH)-CH2OH催化氧化生成(CH3)2C(OH)-CHO,反应方程式为:
2(CH3)2C(OH)-CH2OH+O2$→_{△}^{Cu}$2(CH3)2C(OH)-CHO+2H2O,
故答案为:n(CH3)2C=CH2$\stackrel{催化剂}{→}$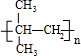 ;
;
2(CH3)2C(OH)-CH2OH+O2$→_{△}^{Cu}$2(CH3)2C(OH)-CHO+2H2O;
(4)(CH3)2C(OH)-COOH的同分异构体中属于酯类,能发生银镜反应,为甲酸酯,能与金属钠反应放出气体,还含有-OH,符合条件的同分异构体有:HOCH2CH2CH2OOCH,CH3CH(OH)CH2OOCH,CH3CH2CH(OH)OOCH,HCOOC(CH3)CH2OH,HCOOC(OH)(CH3)2,共五种,其中核磁共振氢谱有三个峰,且峰面积比为6:1:1的同分异构体的结构简式为:HCOOC(OH)(CH3)2,
故答案为:HCOOC(OH)(CH3)2.
点评 本题考查有机物结构推断、有机反应类型、反应条件、反应特征、及同分异构现象的综合应用,考查核磁共振氢谱的应用、聚合反应等,着重反应部位信息和条件信息的应用和考查.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应属加成反应 | B. | 乙烯可以通过石油裂解获得 | ||
| C. | 乙醇官能团为羟基 | D. | 乙醇、乙醛和乙酸互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n( N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n( N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | 10min内,T1时的v(N2)比T2时的小 | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时,若向平衡后的容器中再充入1.2molCH4,重新达到平衡时n(N2)=0.40mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| X | Y | ||
| Z | W |
| A. | W的原子半径最大 | |
| B. | Z与X形成的化合物难溶于水 | |
| C. | Y的单质不能与水反应 | |
| D. | Z元素的氧化物对应水化物的酸性一定弱于W的氧化物对应水化物的酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室里熔化氢氧化钠时,可选用石英坩埚和铁坩埚 | |
| B. | 不法商家制取的“地沟油”具有固定的熔沸点 | |
| C. | 食品保鲜膜按材质可分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC)等,PVC的单体可由PE的单体与氯化氢加成制得 | |
| D. | 家庭用食用醋代替CO2来增强漂白粉的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
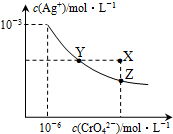 t℃时,AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
t℃时,AgCl的Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 在t℃时,AgCl的溶解度大于Ag2CrO4 | |
| B. | 在t℃时,Ag2CrO4的Ksp=1×10-12 | |
| C. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X点 | |
| D. | 在t℃时,用AgNO3标准溶液滴定20mL未知浓度的KCl溶液,不能采用K2CrO4溶液为指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 4:l3 | C. | 3:4 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | c(OH-)•c(H+) | ||
| C. | c (OH-) | D. | H+的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
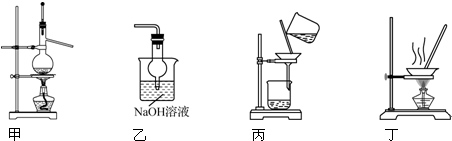
| A. | 用装置甲以乙醇和浓硫酸为原料制乙烯 | |
| B. | 用装置乙吸收某些实验尾气中的二氧化硫 | |
| C. | 用装置丙分离Cl2与KI溶液反应生成的碘 | |
| D. | 用装置丁蒸干NH4Cl饱和溶液获取NH4Cl晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com