
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| C. | 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,还能沉降水中的悬浮物 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片和半导体器件的制造 |
分析 A.氨水与氯气发生氧化还原反应,生成氯化铵、氮气;
B.催化剂不能改变平衡状态;
C.K2FeO4具有强氧化性,还原生成的铁离子可水解生成具有吸附性的氢氧化铁;
D.硅可导电,为半导体材料.
解答 解:A.氨水与氯气发生氧化还原反应,生成氯化铵、氮气,如氯气泄漏,可观察到有白烟生成,故A正确;
B.催化剂不能使平衡发生移动,转化率不变,故B错误;
C.K2FeO4具有强氧化性,还原生成的铁离子可水解生成具有吸附性的氢氧化铁,则可杀菌消毒,还能沉降水中的悬浮物,故C正确;
D.硅可导电,可用于太阳能电池、计算机芯片和半导体器件的制造,故D正确.
故选B.
点评 本题考查较为综合,涉及物质的性质、用于以及催化剂等知识,为高考常见题型和高频考点,侧重化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:解答题
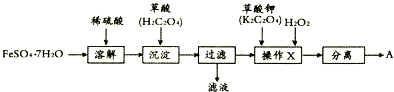
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.6 | B. | 0.9 | C. | 1.6 | D. | 1.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
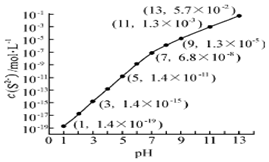 自然界中存在着S元素,它对生物具有重要的作用.
自然界中存在着S元素,它对生物具有重要的作用.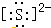 .
.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×l0-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 向冰醋酸中逐滴加水,醋酸的电离度和pH先增大后减小 | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | 25℃时,在CH3COOH溶液与NaCN溶液中,水的电离程度前者大 | |
| D. | amol•L-1HCN溶液与bmol•L-1NaOH溶液等体积混合,所得溶液中c(Na+)<c(CN-),则b一定小于a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
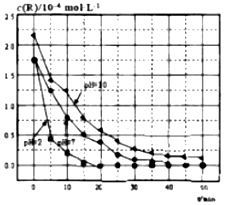
| A. | 对比pH=7和pH=10的曲线,在同一时刻,能说明R的起始浓度越大,降解速率越大 | |
| B. | 对比pH=2和pH=7的曲线,说明溶液酸性越强,R的降解速率越大 | |
| C. | 在0~20min之间,pH=2时R的平均降解速率为0.0875×10-4mol•L-1•min-1 | |
| D. | 50min时,pH=2和pH=7时R的降解百分率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
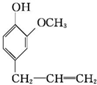 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: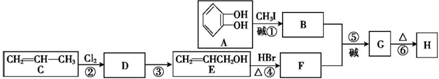
 (X代表卤素原子);
(X代表卤素原子);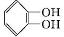 +CH3I$\stackrel{碱}{→}$
+CH3I$\stackrel{碱}{→}$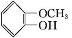 +HI.
+HI.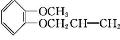 .
.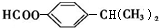 (任写一种).
(任写一种).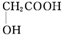 )及化合物A为原料经如下步骤可合成邻苯氧乙酸酚酯:
)及化合物A为原料经如下步骤可合成邻苯氧乙酸酚酯: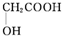 $\stackrel{反应条件Ⅰ}{→}$G$→_{②A/碱}^{①Na_{2}CO_{3}溶液}$H$\stackrel{酸化}{→}$$\stackrel{反应条件Ⅱ}{→}$
$\stackrel{反应条件Ⅰ}{→}$G$→_{②A/碱}^{①Na_{2}CO_{3}溶液}$H$\stackrel{酸化}{→}$$\stackrel{反应条件Ⅱ}{→}$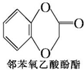
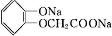 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com