
关于1s、2s、3s、4s原子轨道的说法,正确的是 ( )
A.电子只能在电子云轮廓图中运动
B.能级不同,电子云轮廓图形状相同
C.轨道数目相同,电子云轮廓图形状、大小完全相同
D.能层不同,电子云轮廓图形状也不相同
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
用“酸性”、“碱性”、“中性”或“不确定”填空。
(1)pH<7的溶液( )
(2)pH=7的溶液( )
(3)c(H+)=c(OH-)的溶液( )
(4)c(H+)=1×10-7mol·L-1的溶液( )
(5)c(H+)>c(OH-)的溶液( )
(6)0.1 mol·L-1的NH4Cl溶液( )
(7)0.1 mol·L-1的NaHCO3溶液( )
(8)0.1 mol·L-1的NaHSO3溶液( )
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F代表6种元素。请填空:
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为__________。
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的元素符号为________。
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为_____。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为____________________________________。
(5)F元素的原子最外层电子排布式为nsnnpn+1,则n=________;原子中能量最高的是________电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
基态硼原子的电子排布式为
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p3;④1s22s22p5。则下列有关比较中正确的是 ( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价:④>①>③=②
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
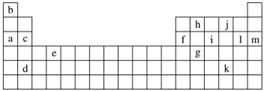
(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要
的能量主要受两大因素的影响:①原子核对核外电子的吸引力,②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量:________________________________________。
②表中X可能为以上13种元素中的________(填写字母)元素,则该元素属于________区。用元素符号表示X和j所能形成的化合物的化学式是__________。
③Y是周期表中________族元素。
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需要的能量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M如下图(组成E、G、L、M分子的元素原子序数均小于10),则下列判断错误的是( )
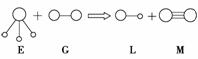
A.G是最活泼的非金属单质
B.L分子内的化学键是极性键
C.E能使紫色石蕊试液变蓝色
D.M化学性质活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
同一温度下,强电解质溶液a、弱电解质溶液b、金属导体c三者的导电能力相同,若升高温度后,它们的导电能力强弱顺序是( )
A.b>a>c B.a=b=c
C.c>a>b D.b>c>a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com