
分析 X、Y、Z、R为原子序数依次增大的前四周期元素,R是ⅤⅢ族元素中原子序数最小的元素,则R为Fe;X、Y、Z为主族元素,X为第二周期的非金属元素,其第一电离能大于同周期左、右相邻的元素,处于ⅢA族或VA族,X、Y、Z的基态原子中,Y、Z的L层均充满电子,X、Y、Z的最外层电子数之和为18,X只能处于VA族,而Y、Z只能处于第三周期,且分别处于VIA族、ⅦA族,故X为N元素、Y为S元素、Z为Cl.
解答 解:X、Y、Z、R为原子序数依次增大的前四周期元素,R是ⅤⅢ族元素中原子序数最小的元素,则R为Fe;X、Y、Z为主族元素,X为第二周期的非金属元素,其第一电离能大于同周期左、右相邻的元素,处于ⅢA族或VA族,X、Y、Z的基态原子中,Y、Z的L层均充满电子,X、Y、Z的最外层电子数之和为18,X只能处于VA族,而Y、Z只能处于第三周期,且分别处于VIA族、ⅦA族,故X为N元素、Y为S元素、Z为Cl.
(1)X为N元素,基态原子的电子排布式是:1s22s22p3,
故答案为:1s22s22p3;
(2)同周期自左而右电负性增大、非金属性增强,S和Cl中电负性更小的是S,HCl稳定性更强,X、Y、Z的单质所形成的晶体中,硫单质为固体,氮气、氯气为气体,而氯气相对分子质量大于氮气,故氮气的沸点最低,
故答案为:S;HCl;氮气;
(3)ClO3-中Cl原子孤电子对数=$\frac{7+1-2×3}{2}$=1,价层电子对数=3+1=4,立体结构型是三角锥形,
故答案为:三角锥形;
(4)一定条件下,Fe单质在O2中燃烧的产物Q为Fe3O4,Y的最高价氧化物为SO3,二者在空气中发生化合反应,生成硫酸盐.当消耗0.2molQ时,共转移了0.2mol电子,同时消耗0.05molO2,则反应的化学方程式是:4Fe3O4+O2+18SO3$\frac{\underline{\;\;△\;\;}}{\;}$6Fe2(SO4)3,
故答案为:4Fe3O4+O2+18SO3$\frac{\underline{\;\;△\;\;}}{\;}$6Fe2(SO4)3.
点评 本题是对位置结构与性质的考查,推断元素是解题关键,较好地考查学生分析推理能力,是对学生综合能力的考查.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| B. | 0.1mol•L-1Na2CO3溶液加热后,溶液的pH减小 | |
| C. | 常温常压下,22.4LCl2中含有的分子数为6.02×1023个 | |
| D. | 室温下,稀释0.1mol•L-1CH3COOH溶液,溶液的导电能力增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水可区分苯和溴苯 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 | |
| D. | 用金属钠可区分乙醇和乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜锌原电池中铜是负极 | |
| B. | 用电解法精炼粗铜时,纯铜作阳极 | |
| C. | 在镀件上电镀铜时可用金属铜作阳极 | |
| D. | 电解稀硫酸制H2、O2时,铜作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制餐具不宜用蒸煮酸性或碱性的食物 | |
| B. | 碳酸钠可用于中和发酵面团中的酸性物质 | |
| C. | 过氧化钠可用于呼吸面具中氧气的来源 | |
| D. | 聚氯乙烯塑料制品可用于食品的包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
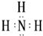 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
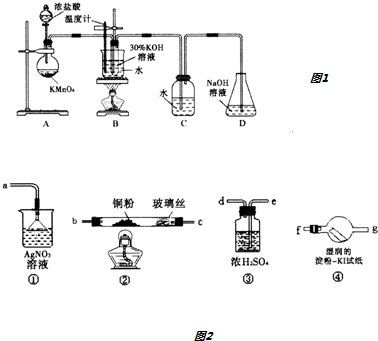
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/ml | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
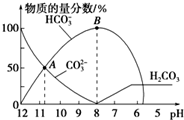 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐渐加入0.1mol•L-1的盐酸,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数的变化如图所示(CO2因逸出未画出,忽略气体逸出而引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| C. | 当溶液的pH为7时,溶液中的阴离子只有两种 | |
| D. | 25℃时,HCO3-的电离平衡常数Ka=5×10-11,当溶液的pH=10时,c(HCO3-)=2c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com