
【题目】下列物质溶于水后溶液显碱性的是
A. SO2 B. NaHCO3 C. NH4NO3 D. KCl
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的铁粉加入到装有100 mL某浓度的稀硝酸溶液中充分反应。
(1)容器中剩有m g的铁粉,收集到NO气体448 mL(标准状况下)。
①所得溶液中的溶质的化学式为________________________。
②原稀硝酸的物质的量浓度为____________________。
(2)向上述固液混合物中逐渐滴加稀硫酸直至刚好不再产生气体为止,该气体遇空气变成红棕色,此时容器中有铁粉n g。
①此时溶液中的溶质的化学式为______________________。
②mn的值为________(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。
I 、金属Ca 的部分性质有:
① 常温或加热条件下Ca都能与氧气反应;
② Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③ Ca + H2=CaH2(固体)。
II 、固体CaH2的部分性质有:
① 常温:CaH2+ 2H2O = Ca(OH)2+2H2;②CaH2要密封保存。
(l)写出Ca常温遇水立即发生反应的化学方程式:_________;其中氧化剂为_________(填化学式)。
(2)用双线桥法标明反应CaH2+ 2H2O = Ca(OH)2+2H2中电子转移的方向和数目________________。
(3)取一定质量的钙,平均分成两等份,一份直接与水反应生成氢气,另一份先生成氢化钙,然后氢化钙与水反应生成氢气,如果不考虑中间的损失,理论上两份产生的氢气的物质的量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr) = 7.7×10-13,Ksp(Ag2CrO4) =9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为 ( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的描述中错误的是( )
A. 水和四氯化碳可以用分液漏斗进行分离
B. 提纯溴水中的溴单质,可以用四氯化碳进行萃取
C. 可以用高温加热的方法除去CaO中混有的CaCO3
D. 可以用蒸发结晶的方法除去KNO3固体中混有的少量NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 煤的液化是物理变化 B. 天然气为可再生能源
C. 食盐溶于水会显著放热 D. 电解水的反应中含有电能转化为化学能的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18mol/L 浓硫酸配制100 ml 1.8mol/L 稀硫酸的实验,回答下列问题:
(1)玻璃仪器除了用到烧杯、量筒、玻璃棒外,还需要用到的玻璃仪器有:_______________。
(2)配制时一般可分为以下几个步骤,请填写有关的空格:
a、将配好的稀硫酸倒入试剂瓶中,贴好标签;
b、盖好容量瓶塞,反复颠倒摇匀;
c、用量筒量取_________ml的18.0 mol·L-1的浓硫酸;
d、将________沿烧杯内壁慢慢注入盛有少量_________的烧杯中;
e、用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
f、将已冷却至室温的硫酸溶液沿玻璃棒注入到容量瓶中;
g、改用胶头滴管逐滴加蒸馏水,至____________________________;
h、继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处;
其中正确的操作顺序为_________________________________________________
(3)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中________________
B. 容量瓶用蒸馏洗涤后残留有少量的水________________
C. 所用过的烧杯、玻璃棒未洗涤__________________
D.量筒量取浓硫酸时仰视刻度线_________________
E. 定容时俯视容量瓶刻度线_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
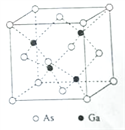
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)写出基态As原子的核外电子排布式________________________。
(2)根据元素周期律,原子半径Ga_____________As,第一电离能Ga____________As。(填“大于”或“小于”)
(3)AsCl3分子的立体构型为____________________,其中As的杂化轨道类型为_________。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_____________________。
(5)GaAs的熔点为1238℃,密度为ρg·cm-3,其晶胞结构如图所示。该晶体的类型为________________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿伏伽德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A. 2.0 mol·L-1 B. 1.5 mol·L-1 C. 0.18 mol·L-1 D. 0.24 mol·L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com