
(10��)Ϊ��̽��ԭ��صĵ缫���Ʋ�����缫�����йػ���������Һ�йأ�ijѧ���������µ�ʵ��
��� | �缫���� | �������Һ | �������� |
�� | Mg�DAl | HNO3(Ũ) | Mg��Al |
�� | Mg�DAl | HCl(aq) | Mg��Al |
�� | Mg�DAl | NaOH(aq) | Al��Mg |
�� | Al�DCu | HNO3(Ũ) | Cu��Al |
�������ϱ������ݻش�
(1)( 4��)ʵ��1��Mg��___________(��������)������__________(������Ӧ��ԭ��Ӧ)
ʵ��3��Mg��___________������__________(ͬ��)
(2) ( 6��)ʵ��2��Mg�缫��ӦʽΪ__________________��
Al�缫�ϵĵ缫��ӦʽΪ_________________________��
�ܵĵ�ط�Ӧ��_______________________________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �¶ȣ��棩 | 10 | 20 | 30 | 50 | 70 | 80 | 100 |
| pH | 8.3 | 8.4 | 8.5 | 8.9 | 9.4 | 9.6 | 10.1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ���Ϻ��л�����������ѧ����ĩ��ѧ�������л�ѧ�Ծ��������棩 ���ͣ�ʵ����
ijѧ����0.1mol/LNaHCO3��Һ�еμӷ�̪��Һ1�Σ�������Һ����û��ʲô�仯������Һ���Ⱥ������Ե���ɫ�����Ƚϳ�ʱ�����ȴ����ɫ����ȥ��
��ѧ��Ϊ���˽�ù��̵�ԭ����������̽�����̣�
��ʵ��̽����
ʵ��1: ����0.1mol/LNaHCO3��Һ�������ҺpH�仯���±�
|
�¶ȣ��棩 |
10 |
20 |
30 |
50 |
70 |
80 |
100 |
|
pH |
8.3 |
8.4 |
8.5 |
8.9 |
9.4 |
9.6 |
10.1 |
ʵ��2��10��ʱ�����ձ��м���0.1mol/LNaHCO3��Һ200mL����ø���ҺpH=8.3�����ȵ�100�棬���pH=10.2���ָ���10�棬pH=9.8��
ʵ��3������0.1mol/LNaHCO3��Һ��������������ͨ�����ʯ��ˮ����Һ����ǡ�
ʵ��4��
������0.1mol/LNaHCO3��Һ��0.1mol/LNa2CO3��Һ��200mL��10��ʱ���ֱ���NaHCO3��ҺpH=8.3��Na2CO3��ҺpH=11.5��
�ڼ�������0.1mol/L NaHCO3��Һ200mL������Һ���100mL��ֹͣ���ȣ���ˮ��200mL����ȴ��ԭ�¶ȣ������ҺpH=9.8��
�۽�0.1mol/L NaHCO3��Һ200mL���ڷ������죬�ټ�ˮ��200mL�������ҺpH=10.1��
���������ʵ��ش��������⣺
��1�������ӷ���ʽ��ʾ0.1mol/LNaHCO3��Һ�д��ڵ�ƽ�⣨��ˮ����ƽ���⣩___________
________________��_______________________________��������ƽ����_______________
����������_______________________________.
��1��ʵ��3�õ��Ľ�����__________________________________________________��
��1�����ʵ��2��3����������0.1mol/LNaHCO3��Һ��pH�����ԭ�������_____________
__________��______________________��________________________________��
��1��ʵ��4�ٵõ��Ľ�����_______________________________________________��
��1��ʵ��4�ڡ���ˮ��200mL����Ŀ����____________________________________________��
ʵ��4�ۿ��Եõ��Ľ�����_______________________________________��
��1��Ҫȷ��NaHCO3��Һ���Ⱥ�pH�������Ҫԭ����Ҫ�����������________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ͬ���� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��17�֣�ijУ��ѧ��ȤС��Ϊ��̽��ԭ��ع���ԭ������������ϵ��ʵ�飺
ʵ��һ ʵ���

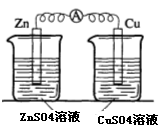


ʵ���� ʵ����
�����
��1��ʵ��һ��ͭƬ��пƬ������к�ɫ����������������ָ��ƫת�����϶�ʱ���ڵ��������Լ�С��ʵ�����ʱ���пƬ������3.94g��ͭƬ������3.84g�����ԭ��صĹ���Ч���ǣ�ָ�μ�ԭ��ط�Ӧ��пռ��Ӧ�����İٷ��ʣ��� ��
��2��ʵ����иս�ͭ��пƬ������Һ��ʱ������ָ����ƫת�������������ˡ�Ϊʲôп�ĵ��Ӳ��ܳ���ͨ����������ͭ����Cu2+�� ��
��3��ʵ������������K+���� ��Һ����ZnSO4��CuSO4�������Zn����������Ϊ1��10-3mol/s����K+��Ǩ������Ϊ mol/s��
��4��ʵ�����е�����ָ����ƫת��д��ͭ���ĵ缫��Ӧʽ�� ![]()
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com