
| A.欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4·7H2O溶解在90 g水中 |
| B.欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| C.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 |
| D.为减小中和滴定误差,锥形瓶必须洗净并烘干后才能使用 |
科目:高中化学 来源:不详 题型:单选题
| A.凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
| B.制取并用排水法收集氧气结束后,应立即停止加热 |
| C.浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液 |
| D.浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.称量氢氧化钠固体质量时,先在两个托盘上各放一张相同质量的纸,再放氢氧化钠 |
| B.在烧杯中溶解固体NaOH,完全溶解后立即将其转移至容量瓶中 |
| C.过滤和配制一定物质的量浓度的溶液时,都需要用玻璃棒进行液体的引流 |
| D.从NaCl溶液中获取晶体时,应将蒸发皿中NaCl溶液全部加热蒸干 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将等物质的量的NaNO3和KCl的混合液加热并浓缩至有晶体析出,趁热过滤时,可分离出NaCl晶体 |
| B.亚硝酸银和氯化银都是白色沉淀,故不能用硝酸银和稀硝酸溶液来区别亚硝酸钠与氯化钠 |
| C.冷却结晶时,如未出现结晶,可以用玻璃棒摩擦瓶壁并将锥形瓶置于冰水中冷却,促使晶体析出 |
| D.在适量氯化钴的乙醇溶液中,逐滴加入水至溶液恰好呈粉红色,加热该溶液,结果依次呈现紫色、蓝紫色、蓝色的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.05 | 21.04 |
| 2 | 25.00 | 1.50 | 24.50 |
| 3 | 25.00 | 0.20 | 20.21 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
[规格]每片含琥珀酸亚铁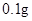 [适应症]用于缺铁性贫血症,预防及治疗用。 [用量用法]成人预防量 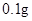 /日,成人治疗量 /日,成人治疗量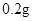 — —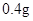 /日。 /日。小儿用量预防量 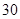 — —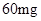 /日,治疗量 /日,治疗量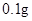 — —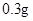 /日 /日[贮藏]避光、密封、在干燥处保存。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.清洗做完焰色反应的铂丝——稀盐酸 |
| B.干燥CO气体——浓硫酸 |
| C.洗去附着在试管内壁的硫——热NaOH溶液 |
| D.洗去附着在试管内壁的氯化银——稀硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com