
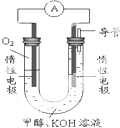
 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| 消耗量 |
| 起始量 |
| 9.8g |
| 98g/mol |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 1.6mol |
| 2mol |
| 9.8g |
| 98g/mol |
| 0.1mol |
| 0.5L |


科目:高中化学 来源: 题型:
 数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
数十年来,化学工作者对碳的氧化物做了广泛深入的研究并取得了一些重要成果.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业合成氨的反应,往往需要使用催化剂 |
| B、工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| C、Fe(SCN)3溶液中加入少量固体KSCN后颜色变深 |
| D、实验室用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、先加BaCl2溶液有白色沉淀,再加稀HNO3溶液不溶解,则试样中一定有SO42- |
| B、加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,则试样中一定有CO32- |
| C、加入氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则试样中一定有NH4+ |
| D、透过蓝色钴玻璃观察到焰色为紫色,则试样中一定有钾元素、没有钠元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
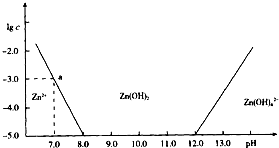 已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.
已知Zn2+与碱反应可生成白色沉淀,碱过量,白色沉淀溶解生成Zn(OH)42-.如图是向含Zn2+的溶液中逐滴加入氢氧化钠溶液的变化过程示意图,横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数值.回答下列问题.| c(HCl)(mol?L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| c(PbCl2)(mol?L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种难溶盐电解质,其中Ksp小的溶解度一定小 |
| B、溶液中存在两种可以与同一沉淀剂生成沉淀的离子,则Ksp小的一定先沉淀 |
| C、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
| D、凡是能自发进行的化学反应,一定是△H<0、△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com