
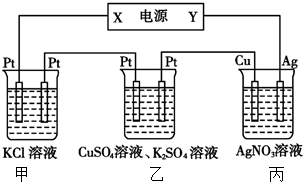
| A. | 当甲装置中共产生标准状况下4.48 L气体时,Cu电极上质量增加43.2g | |
| B. | 电解过程中装置丙的pH无变化 | |
| C. | 向甲中通人适量的HCl气体,可使溶液恢复到电解前的状态 | |
| D. | 乙中左侧电极反应式:Cu2++2e-=Cu |
分析 A、装置甲发生的反应可得两电极产生的气体是体积相等,结合共产生标准状况下4.48 L气体来静思园即可;
B、装置内阴极析出银单质,阳极上的银失去电子变成银离子,据此计算;
C、装置甲中开始的反应为:2KCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2KOH+H2↑+Cl2↑,使溶液恢复遵循:出什么加什么的原理;
D、乙装置的左侧电极质量增加,则左侧为阴极,由此可确定X极为负极,Y为正极,据此判断.
解答 解:A、由装置甲发生的反应可得两电极产生的气体体积相等,所以产生氢气为2.24 L,转移电子0.2 mol,则铜电极上生成Ag0.2 mol,质量为21.6 g,故A错误;
B、装置内阴极析出银单质,阳极上的银失去电子变成银离子,理论上溶液的物质的量浓度不变,pH保持不变,故B正确;
C、装置甲中开始的反应为:2KCl+2H2O2KOH+H2↑+Cl2↑,故要使溶液恢复可通入适最HCl气体即可,故C正确;
的、乙装置的左侧电极质量增加,则左侧为阴极,由此可确定X极为负极,Y为正极,乙装置中铜离子放电,故D正确.
故选A.
点评 本题考查电化学基础的有关知识,涉及电解和电镀的应用,注意知识的归纳和梳理是关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | FeO和Fe2O3的混合物 | B. | Fe2O3和Fe3O4的混合物 | ||
| C. | CuO和Fe2O3的混合物 | D. | CuO和Fe3O4的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 所含离子 | NO3- | SO42- | H+ | M |
| 浓度/(mol•L-1) | 2 | 1 | 2 | 1 |
| A. | Mg2+ | B. | Ba2+ | C. | F- | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 电解Na2SO4饱和溶液,若生成2 NA个H2,一定生成NA个O2 | |
| C. | 常温常压下,46 g NO2的原子数为3NA | |
| D. | 1 mol NO,与H2O完全反应时转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 6.7 | 3.7 | 9.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com