


科目:高中化学 来源: 题型:
| A、FeCl2溶液中通入Cl2 Fe2++Cl2═Fe3++2Cl- |
| B、SiO2与NaOH溶液反应 SiO2+2OH-+2Na+═Na2SiO3+H2↑ |
| C、FeCl3溶液与铜 Fe3++Cu═Fe2++Cu2+ |
| D、用稀硫酸除去铁锈 Fe2O3+6H+═2Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 键能 | 键能 | 键能 | 键能 | ||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 431 | H-O | 464 |
| S═S | 255 | H-S | 339 | C-F | 427 | C-O | 347 |
| C-Cl | 330 | C-I | 218 | H-F | 565 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
 在常温常压下,可利用下列装置来测定气体体积,抽气装置E用以调节装置中的气压差,减小实验误差.
在常温常压下,可利用下列装置来测定气体体积,抽气装置E用以调节装置中的气压差,减小实验误差.查看答案和解析>>
科目:高中化学 来源: 题型:
 人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.
人们应用原电池原理制作了多种电池,以满足不同的需要.以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
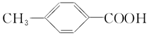 )是一种广泛应用于制备止血芳酸、农药杀虫剂、感光材料的白色晶体,已知其有多种同分异构体,其中属于酯类(分子结构形式为:
)是一种广泛应用于制备止血芳酸、农药杀虫剂、感光材料的白色晶体,已知其有多种同分异构体,其中属于酯类(分子结构形式为: ,R为烃基或H,R′为烃基),且分子结构中含有甲基和苯环的同分异构体的种数为( )
,R为烃基或H,R′为烃基),且分子结构中含有甲基和苯环的同分异构体的种数为( )| A、3种 | B、4种 | C、5种 | D、6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com