
(1)利用如图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。

(2)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入肼的一极为 极,该极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(3)碘被称为 “智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,可通过电解制备碘酸钾。(阴、阳两极均用惰性电极,阴极室与阳极室用阳离子交换膜隔开)请回答下列问题:电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为 。
(1)N;牺牲阳极的阴极保护法
(2)负极 ; N2H4 + 4OH--4e-= N2↑ + 4H2O ; 减小
(3)2I—-2e—=I2 或 I—-6e—+6OH—=IO3—+3H2O;
【解析】
试题分析:(1)作原电池正极或作电解池阴极的金属被保护,若X为碳棒,为减缓铁的腐蚀,则铁应作电解池阴极,所以开关K应该置于处N处;若X为锌,开关K置于M处,该装置构成原电池,锌易失电子作负极,铁作正极而被保护,该电化学防护法称为牺牲阳极的阴极保护法;(2)肼--空气燃料电池是一种碱性燃料电池,工作时负极上燃料肼失电子发生氧化反应,电极反应式为N2H4-4e-+4OH-=N2↑+4H2O,电池总反应式为N2H4+O2=N2+2H2O,反应生成水,OH-浓度减小,则pH减小;(3)电解时阳极附近的阴离子有碘离子、碘酸根离子和氢氧根离子,电解过程中阳极上碘离子失电子生成碘单质,电极反应式为:2I--2e-=I2或 I—-6e—+6OH—=IO3—+3H2O。
考点:考查原电池原理、电解原理的应用,金属的腐蚀与防护。


科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学试卷(A卷)(解析版) 题型:选择题
如图,将纯Fe棒和石墨棒插入1 L饱和NaCl溶液中。下列说法正确的是( )
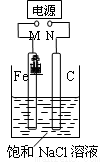
A.M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况)时,生成1 mol NaOH
B.M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红
C.M接负极,N接正极,若把烧杯中溶液换成1 L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀
D.M接电源正极,N接电源负极,将C电极换成Cu电极,电解质溶液换成CuSO4溶液,则可实现在铁上镀铜
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:填空题
(8分)用氯化铝溶液与氢氧化钠溶液反应时:
(1)当Al3+的物质的量与OH-的物质的量之比为 时,Al(OH)3沉淀量最多;
(2)当Al3+的物质的量与OH-的物质的量之比 时,Al(OH)3全部溶解;
(3)当Al3+的物质的量与OH-的物质的量之比 或 时,Al(OH)3沉淀量为最多沉淀量的一半。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:选择题
以下物质间的每步转化都可以通过一步反应能实现的是( )
A.Al-Al2O3-Al(OH)3-NaAlO2 B.Fe-FeO-Fe(OH)2-Fe(OH)3
C.Si-SiO2-H2SiO3-Na2SiO3 D.Na-Na2O2-Na2CO3-NaOH
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:选择题
下列说法正确的是( )
A.合金是指由几种金属熔合而成的具有一定金属特性的物质
B.光导纤维的主要成分是晶体硅
C.硅石、石英、水晶、玛瑙中都含有二氧化硅
D.明矾净水是因为其具有杀菌消毒的性质
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二下学期期末考试化学试卷(解析版) 题型:计算题
在一定温度下,测得0.1 mol·L-1CH3COOH溶液的PH为3.0。则CH3COOH在水中的电离度为 ,此温度CH3COOH的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二下学期期末考试化学试卷(解析版) 题型:选择题
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
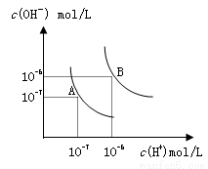
A.纯水中25℃时的c(H+)比100℃时的c(H+)大
B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3
C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D.25℃时,某Na2SO4 溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二5月月考化学试卷(解析版) 题型:填空题
防治环境污染,改善生态环境已成为全球共识。
①2013年,全国多个省市出现严重的雾霾天气。导致雾霾形成的主要污染物是 (填字母);
A.O2 B.CO2 C.PM2.5
②采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾.
A.废电池 B.易拉罐 C.玻璃瓶
在焚烧处理前,除废电池外,还有 (填字母)应剔除并回收,随意丢弃电池造成的主要危害是 。
③漂白粉可用于生活用水的杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高一5月月考化学试卷(解析版) 题型:填空题
某温度下向1L密闭容器中充入1mol N2和3 mol H2,使反应N2+3H2
2NH3达平衡,平衡混合气中N2、H2、NH3的浓度分别为M、N、G(mol/L).如果温度不变,只改变初始物质的加入量,要求M、N、G保持不变,则N2、H2、NH3的加入量用x、y、z表示时应满足的条件是:
①若x=0,y=0,则z= ;
②若x=0.75 mol,则y= ,z= ;
③x、y、z取值必须满足的一般条件是(用含x、y、z方程表示,其中一个含x、z,另一
个含y、z) 。
若将上述条件改为恒温、恒压,其它均不变,则
a.若x=0,y=0,则z= ;
b.若x=0.75 mol,则y= ,z= ;
c.x、y、z取值必须满足的一般条件是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com