
【题目】重要的化工原料乙烯主要来自( )
A. 石油B. 煤炭C. 淀粉D. 酒精
科目:高中化学 来源: 题型:
【题目】废旧印刷电路板的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJmol﹣1
2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJmol﹣1
H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 .
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的化学方程式书写及反应类型判断均正确的是( )
A.甲烷与氯气反应:CH4+Cl2 ![]() CH3Cl+HCl(加成反应)
CH3Cl+HCl(加成反应)
B.乙烯与水在一定条件下生成乙醇:CH2=CH2+H2O ![]() C3CH2OH(加成反应)
C3CH2OH(加成反应)
C.麦芽糖制葡萄糖: ![]() +H2O
+H2O ![]() (氧化反应)
(氧化反应)
D.乙醛与银氨溶液反应:CH3CHO+2Ag(NH3)2OH ![]() CH3COONH4+3NH3+2Ag↓+H2O(取代反应)
CH3COONH4+3NH3+2Ag↓+H2O(取代反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂,某化学小组的同学在老师的指导下制备氢化钙.
【查阅资料】
Ⅰ.金属Ca的部分性质有:
①常温或加热条件下Ca都能与氧气反应;
②Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③Ca+H2 ![]() CaH2(固体)
CaH2(固体)
Ⅱ.固体CaH2的部分性质有:
①常温:CaH2+2H2O=Ca(OH)2+2H2↑; ②CaH2要密封保存.
【进行实验】
该小组同学设计的制取装置如图所示(固定装置略).
回答下列问题:
(1)写出Ca常温遇水发生反应的化学方程式: .
(2)B、D中所盛试剂相同,该试剂为(填名称);D中该试剂的作用是 .
(3)实验时先打开A中活塞,一段时间后,再点燃C中酒精灯,其目的是: .
【实验反思】
该小组同学通过反思提出问题:上述制得的CaH2是否纯净?
他们再次设计实验进行检验,实验步骤如下:
步骤1:检查装置气密性,装入足量的水和已称好质量为m g的CaH2样品,按图所示连接仪器(固定装置略).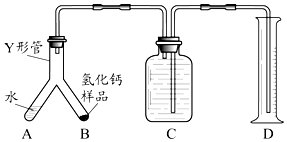
步骤2:将Y形管倾斜,使A中的水全部进入B中,样品全部反应后,冷却至室温,读取量筒读数为V mL.
(4)若该实验条件下的气体摩尔体积为Vm L/mol,当V=mL时(用m、Vm表示),表明制得的CaH2样品是纯净的.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列金属的冶炼方法说法不正确的是( )
A. 汞、银等不活泼金属用热分解法
B. 钾、钠、钙、镁等活泼金属用电解法
C. 铝、锌、铁、铅、铜等金属用热还原法
D. 氢气、碳、铝等都可用作冶炼金属的还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.84gcm﹣3 , 溶质的质量分数为98%的硫酸,配制250mL物质的量浓度为0.46molL﹣1的硫酸.
(1)98%的浓硫酸的物质的量浓度为 .
(2)现有下列几种规格的仪器,应选用(用序号填空).
①10mL量筒 ②50mL量筒 ③100mL量筒 ④100mL容量瓶 ⑤250mL容量瓶
(3)容量瓶上标有、和 .
(4)下列操作使所配溶液的物质的量浓度偏高的是 .
A.往容量瓶中转移溶液时有少量液体溅出
B.未洗涤稀释浓H2SO4的小烧杯
C.定容时俯视刻度线
D.洗净容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炼油厂常将裂解产生的其它烯烃加氢,对产物再次裂解以提高乙烯产量.相关加成反应如下: ① 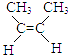 (g)+H2(g)CH3CH2CH2CH3(g)△H1
(g)+H2(g)CH3CH2CH2CH3(g)△H1
② 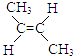 (g)+H2(g)CH3CH2CH2CH3(g)△H2
(g)+H2(g)CH3CH2CH2CH3(g)△H2
(1)已知反应①、反应②平衡常数k1、k2如下,下列叙述正确的是;
温度(℃) | 300 | 320 | 340 |
K1 | 4.8×10﹣4 | 2.5×10﹣4 | 1.3×10﹣4 |
K2 | 8.4×105 | 3.5×103 | 1.6×103 |
A.△H1>0;△H2<0
B.反应①、反应②都是丙烯加氢,所以△H1═△H2
C.相同条件下反应②的转化率大于反应①的转化率
D.从平衡常数推测,相同条件下反应②的反应速率很大,反应①的反应速率很小
(2)2﹣丁烯的顺、反异构转换过程的△H═(用△H1、△H2表示) 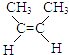 (g)→
(g)→ 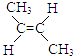 (g)△H
(g)△H
(3)在一定温度下,将等物质的量的反式2﹣丁烯和H2充入2L密闭容器中,发生反应②,容器内各物质浓度如图所示: 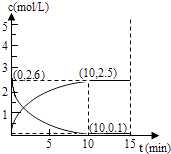
①前10分钟,平均反应速率v(H2)为molL﹣1min﹣1
②该温度下,此反应平衡常数K=(平衡常数不用写单位)
(4)已知表示H2和CH3CH2CH3标准燃烧热的热化学方程式为: H2(g)+ ![]() O2(g)→H2O(l)△H═﹣285.8kJmol﹣1
O2(g)→H2O(l)△H═﹣285.8kJmol﹣1
CH3CH2CH3(g)+5O2(g)→3CO2(g)+4H2O(l)△H═﹣2215kJmol﹣1
丁烯加成反应的热化学方程式为:
CH3CH=CH2(g)+H2(g)→CH3CH2CH3(g)△H═﹣125.4kJmol﹣1
则表示CH3CH=CH2标准燃烧热的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表述为:2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O.
(1)请分析该反应中电子转移的情况(用单线桥法表示): .
(2)浓盐酸在反应中显示出来的性质是 (填写编号).
①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性.
(3)若产生0.1mol Cl2 , 则转移的电子的物质的量为 .
(4)ClO2具有很强的氧化性.因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的倍.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com