
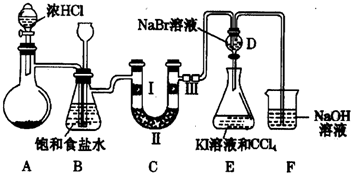
分析 在加热条件下,浓盐酸和二氧化锰在A中反应生成氯气,浓盐酸具有挥发性,导致生成的氯气中含有HCl,用饱和食盐水除去氯气中HCl,氯气没有漂白性但次氯酸没有漂白性,氯气和溴化钠反应生成溴,溴能和KI反应生成碘单质,氯气有毒不能排空,应该用NaOH溶液处理尾气;
(1)加热条件下,浓盐酸和二氧化锰反应生成氯气;和盐酸反应的化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,根据氯气和转移电子之间关系式计算;
(2)饱和食盐水能抑制氯气溶解且能溶解氯化氢,该装置还能贮存少量氯气;
C装置发生堵塞会导致B中压强增大;
(3)要验证氯气没有漂白性,应该用干燥剂干燥氯气然后用干燥的红色布条检验;
(4)氯气也能氧化碘离子生成碘;有毒的氯气和氢氧化钠反应生成无毒物质;
(5)氯气和亚硫酸钠反应生成盐酸和硫酸钠,但盐酸能和亚硫酸钠反应生成二氧化硫;
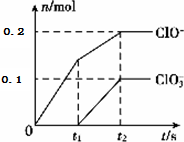
(6)根据图知,t2时刻n(ClO3-)=0.1mol、n(ClO-)=0.2mol,根据转移电子守恒得n(Cl-)=$\frac{0.1×5+0.2×1}{1}$=0.7mol,根据Cl原子守恒得n(C12)=$\frac{1}{2}$[n(ClO3-)+n(ClO-)+n(Cl-)]=1mol,则C12、NaCl、NaClO、NaC1O3的物质的量之比为5:7:2:1,再结合原子守恒配平方程式.
解答 解:在加热条件下,浓盐酸和二氧化锰在A中反应生成氯气,浓盐酸具有挥发性,导致生成的氯气中含有HCl,用饱和食盐水除去氯气中HCl,氯气没有漂白性但次氯酸没有漂白性,氯气和溴化钠反应生成溴,溴能和KI反应生成碘单质,氯气有毒不能排空,应该用NaOH溶液处理尾气;
(1)加热条件下,浓盐酸和二氧化锰反应生成氯气,离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O;和盐酸反应的化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O,反应生成3molCl2,转移电子5mol,则反应中每生成1mol Cl2时转移电子个数为1.67NA或5NA/3,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O;1.67NA或5NA/3;
(2)饱和食盐水能抑制氯气溶解且能溶解氯化氢,该装置还能贮存少量氯气,所以B装置作用是除去HCl气体、贮存少量C12;
C装置发生堵塞会导致B中压强增大,长颈漏斗内的液面上升,瓶内液面下降,
故答案为:除去HCl气体;贮存少量C12;长颈漏斗内的液面上升,瓶内液面下降;
(3)要验证氯气没有漂白性,应该用干燥剂干燥氯气然后用干燥的红色布条检验,则II、III处加入的物质为无水CaC12和干燥的红布条,故答案为:无水CaC12;干燥的红布条;
(4)将氯气通入溴化钠溶液中,导致溶液中可能含有氯气,
氯气也能氧化碘离子生成碘,导致干扰实验;有毒的氯气和氢氧化钠反应生成无毒物质,反应方程式为C12+2NaOH=NaCl+NaClO+H2O,
故答案为:可能会有C12溶于水中;C12+2NaOH=NaCl+NaClO+H2O;
(5)氯气和亚硫酸钠反应生成盐酸和硫酸钠,但盐酸能和亚硫酸钠反应生成二氧化硫,离子方程式为C12+SO32-+H2O=2Cl-+SO42-+2H+、2H++SO32-=H2O+SO2↑,
故答案为:C12+SO32-+H2O=2Cl-+SO42-+2H+;2H++SO32-=H2O+SO2↑;
(6)根据图知,t2时刻n(ClO3-)=0.1mol、n(ClO-)=0.2mol,根据转移电子守恒得n(Cl-)=$\frac{0.1×5+0.2×1}{1}$=0.7mol,根据Cl原子守恒得n(C12)=$\frac{1}{2}$[n(ClO3-)+n(ClO-)+n(Cl-)]=1mol,则C12、NaCl、NaClO、NaC1O3的物质的量之比为5:7:2:1,再结合原子守恒配平方程式为5C12+l0NaOH=7NaCl+2NaClO+NaC1O3+5H2O,
故答案为:5C12+l0NaOH=7NaCl+2NaClO+NaC1O3+5H2O.
点评 本题考查性质实验方案设计,为高频考点,涉及气体制备、除杂、干燥、尾气处理及氧化还原反应,明确实验原理、实验操作是解本题关键,难点是(6)题有关计算,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.用0.1mol•L-1 NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )
已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19.用0.1mol•L-1 NaOH溶液滴定20mL0.1mol•L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法不正确的是( )| A. | a点所得溶液中;2n(H2A)+n(A2-)=0.002mol | |
| B. | b点所得溶液中:c(H2A)+c(H+)=c(A2-)+e(OH-) | |
| C. | C点所得溶液中:c(Na+)<3c(HA-) | |
| D. | d点所得溶液中:c(Na+)>c(A2-)>c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不粘锅的内壁有聚四氟乙烯涂层,它不能使酸性高锰酸钾溶液褪色 | |
| B. | 干馏煤可以得到甲烷、苯和氨等重要化工原料 | |
| C. | 用于奥运“祥云”火炬的丙烷是一种清洁燃料 | |
| D. | 淀粉和纤维素的组成都是(C6H10O5)n,两者互为同分异构体,且水解最终产物都是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
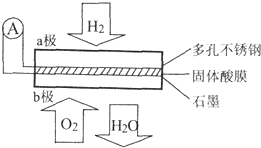 某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )
某固体酸燃料电池以CaHSO4固体为电解质传递H+,其基本结构如图所示,电池总反应可表示为:2H2+O2=2H2O,下列有关说法错误的是( )| A. | H+由b极通过固体酸电解质传递到a极 | |
| B. | b极上的电极反应式为:O2+4H++4e-=2H2O | |
| C. | 每转移0.4 mol电子,生成3.6g水 | |
| D. | 电池工作时,化学能主要转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a:b | B. | a:2b | C. | a:(2a+2b) | D. | a:(a+2b) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | CH3CH2CH2CH2CH3 | C. | 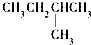 | D. | 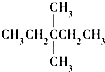 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com