
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
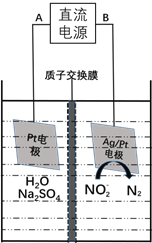
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。
【答案】 ![]()
![]()
![]() 0.008mol/(L·s) 0≤a<0.8(或a<0.8) B
0.008mol/(L·s) 0≤a<0.8(或a<0.8) B ![]() (或
(或![]() ) 32
) 32
【解析】(1)根据焓变=反应物总键能-生成物总键能,则反应①NO2 (g)+ CO(g)![]() CO2 (g)+ NO(g) ΔH1=(812+1076-1490-632)kJ/mol =-234 kJ/mol,②N2(g)+O2(g)
CO2 (g)+ NO(g) ΔH1=(812+1076-1490-632)kJ/mol =-234 kJ/mol,②N2(g)+O2(g) ![]() 2NO(g) ΔH2=+179.5 kJ/mol ;③2NO(g) +O2(g)
2NO(g) ΔH2=+179.5 kJ/mol ;③2NO(g) +O2(g)![]() 2NO2(g) ΔH3=-112.3 kJ/mol ;根据盖斯定律,由③+①×2-②得反应2NO(g) + 2CO(g)= N2(g)+ 2CO2 (g) ΔH=ΔH3+ΔH1×2-ΔH2 =-112.3 kJ/mol +(-234 kJ/mol)×2-179.5 kJ/mol =-759.8 kJ/mol;当总反应式相加时平衡常数相乘、相减时相除、成倍时为幂,则平衡常数K=
2NO2(g) ΔH3=-112.3 kJ/mol ;根据盖斯定律,由③+①×2-②得反应2NO(g) + 2CO(g)= N2(g)+ 2CO2 (g) ΔH=ΔH3+ΔH1×2-ΔH2 =-112.3 kJ/mol +(-234 kJ/mol)×2-179.5 kJ/mol =-759.8 kJ/mol;当总反应式相加时平衡常数相乘、相减时相除、成倍时为幂,则平衡常数K=![]() ;
;
(2)设达到平衡时CO的浓度改变x,则:
2NO2 + 4CO![]() 4CO2 + N2
4CO2 + N2
起始浓度(mol/L):0.1 0.2 0 0
改变浓度(mol/L): x 2x 2x ![]() x
x
平衡浓度(mol/L):0.1-x 0.2-2x 2x ![]() x
x
故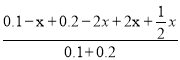 =
=![]() ,解得x=0.02mo/L,v(CO)=
,解得x=0.02mo/L,v(CO)= ![]() =0.008mol/(L·s);
=0.008mol/(L·s);
K=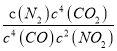 =
=![]() ;若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,则Q=
;若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,则Q=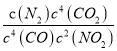 =
=![]() <K=
<K=![]() ,解得a<0.8,a的取值范围为0≤a<0.8或a<0.8;(3)根据电化学降解NO2-的原理图可知,Ag/Pt电极上NO2-转化为N2,氮元素化合价从+3价降为0价,被还原,发生还原反应,作为阴极,则电源B为负极,故①电源的负极是B,阴极反应式为:2NO2-+6e-+4H2O=N2↑+8OH-或2NO2-+6e-+8H+=N2↑+4H2O;②根据图示装置,阳极反应为2H2O-4e-=O2↑+4H+,转移6mol电子时,阳极消耗3mol水,产生6molH+进入阴极室,阳极室质量减少54g;阴极反应为2NO2-+6e-+8H+=N2↑+4H2O,阴极室中放出1molN2(28g),同时有6molH+(6g)进入阴极室,因此阴极室质量减少22g,膜两侧电解液的质量变化差(△m左-△m右)=54g-22g=32g。
,解得a<0.8,a的取值范围为0≤a<0.8或a<0.8;(3)根据电化学降解NO2-的原理图可知,Ag/Pt电极上NO2-转化为N2,氮元素化合价从+3价降为0价,被还原,发生还原反应,作为阴极,则电源B为负极,故①电源的负极是B,阴极反应式为:2NO2-+6e-+4H2O=N2↑+8OH-或2NO2-+6e-+8H+=N2↑+4H2O;②根据图示装置,阳极反应为2H2O-4e-=O2↑+4H+,转移6mol电子时,阳极消耗3mol水,产生6molH+进入阴极室,阳极室质量减少54g;阴极反应为2NO2-+6e-+8H+=N2↑+4H2O,阴极室中放出1molN2(28g),同时有6molH+(6g)进入阴极室,因此阴极室质量减少22g,膜两侧电解液的质量变化差(△m左-△m右)=54g-22g=32g。


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组拟取盐湖苦卤的浓缩液(富含K+、Mg2+、Br﹣、SO ![]() 、Cl﹣等)来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程.
、Cl﹣等)来制取较纯净的氯化钾晶体及液溴,他们设计了如下流程. 
研究性学习小组查寻资料得知:Br﹣被氧化剂氧化成溴.溴不易溶于水而易溶于CCl4回答以下问题:
(1)操作Ⅰ的名称为;要从橙色液体中分离出溴,所采取的操作需要的主要玻璃仪器除酒精灯和温度计外,还有 .
(2)试剂x,y,z的化学式分别为x , y , z;检验SO ![]() 已除尽的方法是 .
已除尽的方法是 .
(3)写出操作Ⅲ的具体操作步骤 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并回答问题:
(1)配制时必须用的仪器有:烧杯、玻璃棒、 .
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次);
A、用30mL水洗涤烧杯2﹣3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处
(3)下列配制的溶液浓度偏低的是 ;
A.称量NaOH时,砝码错放在左盘
B.向容量瓶中转移溶液时(实验步骤C)不慎有液滴洒在容量瓶外面
C.加蒸馏水时不慎超过了刻度线
D.定容时俯视刻度线
E.配制前,容量瓶中有少量蒸馏水
(4)某同学改用固体Na2CO3配制与上述溶液同体积、同浓度的溶液过程如图所示,其错误操作序号是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确表示下列反应的离子方程式的是( )
A. 氢氧化钠溶液与盐酸反应:H++OH-=H2O B. 铁溶于氯化铁溶液:Fe3++Fe=2Fe2+
C. 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷作为一种新能源应用广泛,请回答下列问题:
(1)竖炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:
CH4(g)+CO2(g) =2CO(g)+2H2(g) △H=260kJ·mol-1
2CO(g)+O2(g) = 2CO2(g) △H= -566kJ·mol-1
则CH4与O2反应生成CO和H2的热化学方程式为____________________
(2)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液)通过装置Ⅱ实现铁棒上镀铜

①a处应通入_________(填CH4或O2),b处电极上发生的电极反应式是______;
②电镀结束后,装置Ⅰ中溶液的pH______。(填写变大、变小或不变,下同),装置Ⅱ中Cu2+的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是( )
A. 离子化合物中一定存在离子键,可能存在共价键 B. 非极性键只存在于双原子单质分子中
C. 由金属元素和非金属元素形成的化学键一定是离子键 D. NH4Cl是一种共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中正确的是( )
A. 所有的金属都是固态的 B. 金属具有导电性、导热性和延展性
C. 所有金属能与酸反应 D. 金属元素在自然界中都是以化合态存在的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有21.6g由CO和CO2组成的混合气体,在标况下其体积为13.44L.回答下列问题: 
(1)该混合气体的平均摩尔质量为
(2)混合气体中碳原子的质量为
(3)将混合气体依次通过如下图所示装置,最后收集在气球中(实验在标况下测定) ①气球中收集到的气体的摩尔质量为
②气球的体积为L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com