
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)一定条件下,SO2与O2反应10 min后,若SO2和SO3物质的量浓度分别为0.1 mol/L和0.3 mol/L,则10 min内生成SO3的化学反应速率为___________;SO2的转化率为___________。
(2)下列关于该反应的说法正确的是_________。
A.增加O2的浓度能加快反应速率 B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率 D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中若某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是______。
A.O2为0.2 mol/L B.SO2为0.25 mol/L
C.SO3为0.4 mol/L D.SO2、SO3均为0.15 mol/L
(4)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的化学方程式:___________。
【答案】 0.03mol/(L·min) 75% AC B 2NH3·H2O+SO2=(NH4)2SO3+H2O
【解析】(1)一定条件下,SO2与O2反应10 min后,若SO2和SO3物质的量浓度分别为0.1 mol/L和0.3 mol/L,则10 min内生成SO3的化学反应速率为0.3mol/L÷10min=0.03mol/(L·min);根据硫原子守恒可知SO2的转化率为![]() 。(2)A.增加O2的浓度能加快反应速率,A正确;B.降低体系温度减慢反应速率,B错误;C.使用催化剂能加快反应速率,C正确;D.反应是可逆反应,一定条件下达到反应限度时SO2不能全部转化为SO3,D错误,答案选AC;(3)A.O2为0.2 mol/L时需要消耗0.2mol/L的三氧化硫,由于是可逆反应,因此三氧化硫不可能完全转化,A错误;B.SO2为0.25 mol/L,需要消耗0.05mol/L三氧化硫,此时三氧化硫有剩余,B正确;C.SO3为0.4 mol/L时需要消耗0.2mol/L的二氧化硫,由于是可逆反应,因此二氧化硫不可能完全转化,C错误;D.根据硫原子守恒可知SO2、SO3的浓度之和是0.4mol/L,因此二者不可能均为0.15 mol/L,D错误,答案选B。(4)过量的氨水与SO2反应生成亚硫酸铵,反应的化学方程式为2NH3·H2O+SO2=(NH4)2SO3+H2O。
。(2)A.增加O2的浓度能加快反应速率,A正确;B.降低体系温度减慢反应速率,B错误;C.使用催化剂能加快反应速率,C正确;D.反应是可逆反应,一定条件下达到反应限度时SO2不能全部转化为SO3,D错误,答案选AC;(3)A.O2为0.2 mol/L时需要消耗0.2mol/L的三氧化硫,由于是可逆反应,因此三氧化硫不可能完全转化,A错误;B.SO2为0.25 mol/L,需要消耗0.05mol/L三氧化硫,此时三氧化硫有剩余,B正确;C.SO3为0.4 mol/L时需要消耗0.2mol/L的二氧化硫,由于是可逆反应,因此二氧化硫不可能完全转化,C错误;D.根据硫原子守恒可知SO2、SO3的浓度之和是0.4mol/L,因此二者不可能均为0.15 mol/L,D错误,答案选B。(4)过量的氨水与SO2反应生成亚硫酸铵,反应的化学方程式为2NH3·H2O+SO2=(NH4)2SO3+H2O。


科目:高中化学 来源: 题型:
【题目】下列能说明氯元素比硫元素非金属性强的是
①HC1比H2S稳定 ②HClO4酸性比H2SO4强 ③Cl2能与H2S反应生成s ④Cl2比S更易与H2化合生成相应气态氢化物 ⑤盐酸是强酸,而氢硫酸是弱酸
A. ①②③④⑤ B. ①②④⑤ C. ①②③④ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在pH=12的NaOH溶液中,由水电离出的c(OH-)为( )
A.1.0×10-7mol/LB.1.0×10-6mol/L
C.1.0×10-3mol/LD.1.0×10-12mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2 L的密闭容器中,X、Y、Z(均为气体)三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:
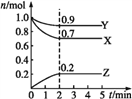
(1)该反应的化学方程式为___________________________。
(2)2 min时反应达到平衡,此时体系内压强与开始时的压强之比为________。
达到平衡时,容器内混合气体的平均相对分子质量比起始时____(填增大、减小或相等)。
(4)若要加快该反应的速率,可以采取的措施有(_____)
A.扩大密闭容器的体积 B.适当升高温度 C.加入正催化剂 D.减小Y的用量
(5)已知该反应为放热反应,2 min后,若要使平衡正向移动,可以采取的措施有(_________)
A.缩小密闭容器的体积 B.适当降低温度 C.加入正催化剂 D.增大Z的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人生病时要合理用药。下列药品与其作用匹配的是
A. 麻黄碱:止咳平喘 B. 阿司匹林:消炎抗菌
C. 青霉素:解热镇痛 D. 医用碘酒:人体补碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定酸碱反应的中和热,计算时至少需要的数据是
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量 ⑤生成水的物质的量 ⑥反应前后温度变化 ⑦操作所需的时间
A. ①②③⑥ B. ①③④⑤ C. ③④⑤⑥ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
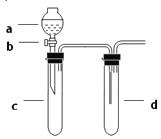
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是 __________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸,c中反应的化学方程式是________________。再由a向c中加2 mL蒸馏水,c中的实验现象是_________________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是___________,理由是___________。
方案 | 反应物 |
甲 | Cu、浓 HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为___________,实验现象为 __________,但此实验的不足之处是 _________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com