
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH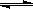 CH3COO-+H+ 对于该平衡,下列叙述正确的是
CH3COO-+H+ 对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向逆反应方向移动 |
| B.升高温度,平衡向正反应方向移动 |
| C.加入水稀释,溶液中c(H+)一定增大 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
科目:高中化学 来源: 题型:计算题
(1)N2(g)+3H2(g) 2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
2NH3(g) △H=-94.4kJ·mol-1。恒容时,体系中各物质浓度随时间变化的曲线如图示。
①在1L容器中发生反应,前20min内,v(NH3)= ,放出的热量为 ;
②25min时采取的措施是 ;
③时段III条件下,反应的平衡常数表达式为 (用具体数据表示)。
(2)电厂烟气脱氮的主反应①:4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g)
5N2(g)+6H2O(g) △H<0,副反应②:2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。
5N2O(g)+3H2O(g) △H>0。平衡混合气中N2与N2O含量与温度的关系如右图。请回答:在400K~600K时,平衡混合气中N2含量随温度的变化规律是 ,导致这种规律的原因是 (任答合理的一条原因)。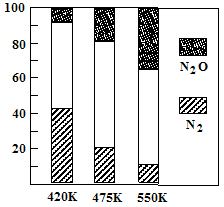
(3)直接供氨式燃料电池是以NaOH溶液为电解质的。电池反应为:4NH3+3O2=2N2+6H2O,则负极电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有 和 。
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 体积/mL | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:常温下浓度为0.1 mol·L-1的下列溶液的pH如表:
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
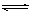 HClO + OHˉ的平衡常数K≈10ˉ7.6
HClO + OHˉ的平衡常数K≈10ˉ7.6查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,Na2CO3溶液中存在平衡:CO32-+H2O HCO3-+OH-,下列有关该溶液的说法正确的是
HCO3-+OH-,下列有关该溶液的说法正确的是
| A.离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(H+) | B.升高温度,平衡向右移动 |
| C.滴入CaCl2浓溶液,溶液的pH增大 | D.加入NaOH固体,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
A.草酸氢钾溶液呈酸性,在0.1mol·L-1KHC2O4溶液中:c(C2O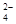 )>c(H2C2O4) )>c(H2C2O4) |
B.在小苏打水溶液中:c(Na+)+c(H+)=c(HCO )+c(CO )+c(CO )+c(OH-) )+c(OH-) |
| C.相同温度下,1 mol/L氨水溶液与0.5mol/L氨水溶液中,c(OH-)之比是2:1 |
D.当氨水与盐酸恰好完全反应时,c(NH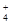 )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在100mL1.0×10-4mol/L的KCl溶液中,加入100mL2.0×10-6mol/L的AgNO3溶液,下列说法正确的是( )
| A.有AgCI沉淀生成 | B.无AgCI沉淀生成 | C.有沉淀生成但不是AgCI | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温时,下列叙述正确的是
| A.pH=9的NH4Cl与NH3?H2O混合溶液中c(Cl-)>c(NH4+) |
| B.pH=2.5的可乐中c(H+) 是pH=3.5的柠檬水中c(H+)的10倍 |
| C.AgCl在0.1mol /L CaCl2溶液和0.1mol/L NaCl溶液中的溶解度相同 |
| D.1 mL 1mol /L Na2CO3溶液加水稀释至100mL, pH和Kw均减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com