
| A. | 微粒半径:r(H-)>r(H+) | B. | H-与Li+电子层结构相同 | ||
| C. | 还原性:H>Li | D. | 碱性:LiOH<NaOH |
分析 A.离子的电子层越多,离子半径越大;
B.H-与Li+的核外都含有1个电子层、2个电子;
C.金属Li比H不容易失去电子;
D.金属性越强,最高价氧化物对应水合物的碱性越强.
解答 解:A.离子的电子层越多,离子半径越大,H-含有1个电子层,H+核外没有电子,则微粒半径:r(H-)>r(H+),故A正确;
B.H-核外电子数为2,Li+的核外含有1个电子层,电子总数也是2,二者电子层结构相同,故B正确;
C.同一主族中还原性逐渐增强,则还原性:H<Li,故C错误;
D.金属性Na>Li,则最高价氧化物对应水合物的碱性:LiOH<NaOH,故D正确;
故选C.
点评 本题考查了原子结构与元素性质,题目难度不大,涉及离子半径大小比较、还原性、碱性强弱比较等知识,明确原子结构与元素性质为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:选择题
| A. | 能与1molH2发生加成反应生成 | |
| B. | 易被酸性KMnO4溶液氧化而使KMnO4溶液褪色 | |
| C. | 与溴水发生加成反应而使溴水褪色 | |
| D. | 一定条件下能与H2O发生加成反生成乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y>Z | |
| B. | 最高价氧化物的水化物酸性:Z>Y>X | |
| C. | XY2中各原子最外层均满足8电子结构 | |
| D. | X的氢化物中化学键均为极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2 | |
| B. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| C. | 利用油脂在碱性条件下的水解,可以制甘油和肥皂 | |
| D. | 植物油和矿物油都不能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液中:K+、Na+、CO32-、AlO2- | |
| B. | 能使酚酞变红的溶液中:Al3+、Cu2+、SO42-、Cl- | |
| C. | c(FeCl3)=0.1mol•L-1的溶液中:Mg2+、K+、SO42-、NO3- | |
| D. | 由水电离产生的c(H+)=1×10-13mol•L-1的溶液中:NH4+、Na+、CH3COO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
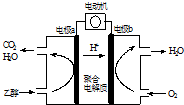
| A. | 燃料电池能量转化率比乙醇燃烧发电低 | |
| B. | 电池工作时,电极a上产生淡蓝色火焰 | |
| C. | 电子由电极a经“聚合电解质”流向电极b | |
| D. | 电池反应为:C2H5OH+3O2→2CO2+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取 | B. | 蒸发灼烧 | C. | 用Fe置换 | D. | 电解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
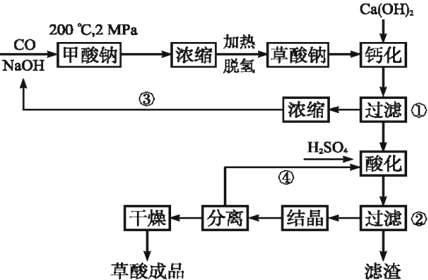
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com