
【题目】白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+![]() O2(g)===
O2(g)===![]() P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。

则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH= 。
【答案】(1)P4(s,白磷)===4P(s,红磷) ΔH=-29.2 kJ·mol-1
(2)3∶1 1323.45 kJ(3)-1326 kJ·mol-1
【解析】(1)根据盖斯定律,由第一个反应-第二个反应×4,可得:P4(s,白磷)===4P(s,红磷) ΔH=-2983.2 kJ·mol-1-(-738.5 kJ·mol-1)×4=-29.2 kJ·mol-1。
(2)n(白磷)=![]() =0.5 mol,n(O2)=
=0.5 mol,n(O2)=![]() =2.25 mol,设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则
=2.25 mol,设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则
x+y=0.5,5x+3y=2.25,
解得x=0.375 mol,y=0.125。
反应过程中放出的热量为:2983.2 kJ·mol-1×0.375 kJ·mol-1+1638 kJ·mol-1×0.125 mol=1323.45 kJ。
(3)根据图示,1分子P4、PCl3中分别含有6个P—P键、3个P—Cl键,反应热为断裂6 mol P—P键、6 mol Cl—Cl键吸收的能量和形成12 mol P—Cl键放出的能量之差,即ΔH=(6×198 kJ·mol-1+6×243 kJ·mol-1)-12×331 kJ·mol-1=-1326 kJ·mol-1。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)不能作为达到平衡状态的依据的是
2NH3(g)不能作为达到平衡状态的依据的是
A. N2,H2和NH3的质量分数不再改变
B. c(N2)∶c(H2)∶c(NH3)=1∶3∶2
C. 断开1 mol H-H的同时形成1 mol H-H
D. 单位时间里每增加1 mol N2,同时消耗3 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
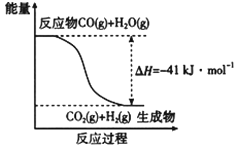
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示,反应的热化学方程式为____________________________________________。
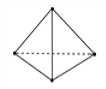
(2)意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,1mol N4生成N2的ΔH=_________ kJ·mol-1
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。298K时,已知:
①C(s,石墨)+O2(g)![]() CO2(g) ΔH1=a kJ·mol-1
CO2(g) ΔH1=a kJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=b kJ·mol-1
2H2O(l) ΔH2=b kJ·mol-1
③2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH3=c kJ·mol-1
4CO2(g)+2H2O(l) ΔH3=c kJ·mol-1
则反应:2C(s,石墨)+H2(g)![]() C2H2(g) 的焓变ΔH=__________(用含a、b、c的式子表示)。
C2H2(g) 的焓变ΔH=__________(用含a、b、c的式子表示)。
(4)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g)![]() 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是____________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是

A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是当今世界最重要的化工产品之一,有关硫酸制备和性质实验如下:
Ⅰ.(1)早在1000多年前,我国就已采用加热胆矾或绿矾(FeSO47H2O)的方法制取硫酸。2FeSO4![]() Fe2O3+SO2↑+SO3↑,将受热产生的气体通入如图1的装置中,以检验产生的气体中是否含有SO2和SO3,写出甲中发生的离子反应方程式______;
Fe2O3+SO2↑+SO3↑,将受热产生的气体通入如图1的装置中,以检验产生的气体中是否含有SO2和SO3,写出甲中发生的离子反应方程式______;
(2)能说明SO2存在的实验现象是______。
Ⅱ.(3)实验室用图2装置制SO2,甲试管倾斜加热的目的是______,加热后试管内发生的化学方程式为______。
(4)有关该实验说法正确的是:______。
A.该反应中浓硫酸只体现酸性
B.试管乙中含有碱液的棉花,其作用是吸收过量的SO2,防止环境污染
C.反应一段时间后,将冷却后试管甲中的溶液缓慢倒入盛有水的烧杯,溶液显蓝色
D.含0.04mol溶质的浓硫酸与足量的铜片反应,能收集到448mL的SO2(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-,易被人体吸收累积而导致肝癌。处理工业含铬废水的方法通常是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。已知元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体。
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是____
(2)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理:_______________
(3)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为_________________
(4)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1 的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
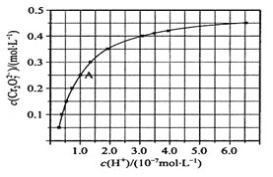
①由图可知,溶液酸性增大,CrO42的平衡转化率_________(填“增大“减小”或“不变”),
② 据A点数据,计算出该转化反应的平衡常数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有关物质制备的说法不正确的是( )
A.工业上电解饱和食盐水制取氯气、烧碱称为侯氏制碱法
B.工业上炼铁用CO做还原剂
C.工业上电解熔融的MgO制备金属镁
D.工业上用焦炭和二氧化硅高温下反应可制得粗硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com